|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
П'ЯТИЧЛЕННІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ З ОДНИМ ГЕТЕРОАТОМОМ
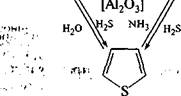
П'ятичленні гетероароматичні сполуки з одним гетероатомом можна розглядати як похідні бензену, в якому угруповання —СН=СН— заміщене на гетероатом. Найважливішими представниками цієї групи гетероциклів є пірол, фурані тіофен: (Р04----- _.3(Р) (Р")4------ ,3(Р) (Р'Н------ ,3(Р) ГЛ /\ ГЛ (а')5Ч. . >2(а) (а') 54. у>2 (а) (а') 54. у>7 (а) н пірол, фуран, тіофен, азол оксол тіол ■ 15.4.1. СПОСОБИ ДОБУВАННЯ Взаємні перетворення фурану, піролу та тіофену (цикл реакцій Юр'ева).Реакції взаємних перетворень фурану, піролу та тіофену вЩкрив радянський хімік-органік Ю. К. Юр'єв у 1936 році. 'Органічна хімія Глава /* Роциклічні сполуки
При каталітичній дії алюміній оксиду та нагріванні (-450 °С) фуран у присутності амоніаку перетворюється на пірол, а в присі тності сірководню — на тіофен. Під дією води за цих умов пірс, і тіофен утворюють фуран. Аналогічно тіофен у присутності амо-
ніаку перетворюється на пірол, на тіофен.
Слід зазначити, що з наведених реакцій тільки перетворення фурану на пірол і тіофен відбувається з високим виходом продукту. ФІЗИЧНІ ВЛАСТИВОСТІ Пірол — це безбарвна рідина із запахом, що нагадує запах хлороформу, т. кип. 130 °С; малорозчинний у воді, добре розчинний в етанолі та бензені. На повітрі темніє та осмолюється. Фуран — безбарвна рідина зі своєрідним запахом, який нагадує запах хлороформу, т. кип. 32 °С. Нерозчинний у воді, добре розчинний в етанолі та діетиловому етері. Тіофен — безбарвна рідина зі слабким запахом сірчистих сполук, т. кип. 84 °С; нерозчинний у воді, добре розчинний в етанолі, етері та бензені. Стійкий до високої температури. На світлі окис-нюється. ХІМІЧНІ ВЛАСТИВОСТІ Реакційна здатність піролу, фурану та тіофену визначається наявністю в їх структурі циклу з я-електрононадлишковою ароматичною системою (шість /^-електронів припадає на п'ять атомі» циклу). Проте ступінь ароматичності згаданих гетероциклів нижчий, ніж у бензену, і залежить від природи гетероатома. Оскільки електронегативність атома Сульфуру менша за електронегативність аТоМІв Нітрогену та Оксигену, ступінь участі неподіленої пари електронів атома Сульфуру в утворенні ароматичного секстету молекули тіофену більший, ніж атома Нітрогену в піролі та атома Оксигену У фурані. Скажімо, якщо для бензену енергія спряження становить 150 кДж/моль, то в ряду тіофен, пірол, фуран вона спадає по мірі збільшення електронегативності гетероатома: тіофен (-130 кДж/моль), пірол (-110 кДж/моль), фуран (-90 кДж/моль). Тому з наведених гетероциклів тіофен за своєю хімічною поведінкою найбільше нагадує бензен, а фуран має найменш виявлений ароматичний характер. У деяких реакціях фуран поводиться як ненасичена (дієнова) сполука. Через електронегативність гетероатома в молекулах піролу, фурану та тіофену, на відміну від бензену, електронна густина розподілена нерівномірно, зокрема на атомах Карбону в а-положенні густина електронів вища, ніж у р-положенні, що визначає напрямок перебігу реакцій електрофільного заміщення. А. Спільні хімічні властивості піролу, фурану та тіофену 1. Взаємодія з мінеральними кислотами.У присутності сильних мінеральних кислот пірол і фуран осмолюються, утворюючи полімерні продукти темного кольору. Ця властивість дістала назву ацидофобність,
О +н+— ( Н Н Н Що означає «кислотобоязнь», від лат. асМит — кислота і грец. фобос — страх. Ацидофобність зумовлена приєднанням протона, переважно до сс-атома циклу, що призводить до порушення ароматичності кільця. Потім відбувається полімеризація утвореної Дієнової структури. Уведення в пірольне ядро електроноакцепторних замісників (—N02, —СООН, —СН=0) веде до зменшення ацидофобності Цих сполук. Тіофен, на відміну від фурану та піролу, не виявляє аЦидофобності, оскільки має стійку ароматичну структуру, яка не Руйнується при дії сильних мінеральних кислот. 2. Реакції електрофільного заміщення.Будучи я-надлишковими аРоматичними системами, пірол, фуран і тіофен легко вступають У характерні для ароматичних сполук реакції електрофільного за- 7*
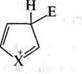
Глава 1$ міщення. Ці реакції відбуваються значно легше, ніж у бензену. За активністю в реакціях з електрофільними реагентами означені ге_ тероцикли розташовуються в ряд: пірол > фуран > тіофен. У першу чергу заміщується атом Гідрогену при атомі Карбону в а-поло-женні; якщо це положення зайняте, заміщення відбувається в Р-положенні. Такий напрямок заміщення зумовлений тим, щ0 за участю атомів Карбону в а-положенні утворюється стійкіший а-комплекє, завдяки більшій можливості для делокалізації позитивного заряду.
атака а-пало-ження
О атака (5-поло-ження
X = О, 8, NН
Нітрування. Зважаючи на ацидофобність фурану та піролу, нітрування їх проводять не самою нітратною кислотою, а продуктом взаємодії нітратної кислоти з оцтовим ангідридом — ацетилнітра-том СН3СО(Ж02. Тіофен неацидофобний, тому його можна про-нітрувати нітратною кислотою за м'яких умов, однак частіше в реакції нітрування тіофену також застосовують ацетилнітрат. Унаслідок нітрування утворюються сс-нітросполуки.
N ацетилнітрат Те ж саме стосується реакції сульфування. Галогенування. Галогенування фурану проходить досить складно. Поряд із заміщенням атомів Гідрогену на галоген залежно від умов проведення реакції утворюються також продукти 2,5-приєД-нання. Пірол з галогенами реагує дуже легко, утворюючи тетрагалоге-нопіроли. Для здобування моногалогенозаміщених похідних піролу потрібні спеціальні умови. Так, при дії на пірол сульфурилхло- Гетероциклічні сполуки____________________________________ ридУ 502С12 відбувається поступове заміщення атоми Гідрогену на галоген. Ш 2 МН NНІЧН пірол 2-хлоропірол 2,5-дихлоропірол тетрахлоропірол Тетрайодпірол (йодол) виявляє властивості антисептика. Галогенування тіофену проводять безпосередньою дією галогену (хлору або брому). Реакція проходить на холоді з утворенням моно-, ди-, три- і тетразаміщених похідних тіофену. тіофен 2-хлоротіофен 2,5-дихлоротіофен тетрахлоротіофен Реакція з йодом відбувається повільно в присутності каталізатора ЩО. 3. Реакції відновлення.Фуран приєднує водень при високій температурі (150 °С) та тиску (10—15 МПа) у присутності каталізатора (нікелю Ренея, паладію) з утворенням насиченого гетероциклу тетрагідрофурану (оксолану).
№ + 2Н, 12 ох "о' фуран тетрагідрофуран Приєднання водню до тіофену в присутності паладієвого каталізатора відбувається значно легше, ніж до фурану (при кімнатній температурі та тиску 0,2—0,4 МПа). У процесі відновлення утворюється тетрагідротіофен.
ра + 2Н, тіофен тетрагідротіофен Пірол, на відміну від фурану та тіофену, гідрується воднем У момент виділення, наприклад, дією цинку в оцтовій кислоті. При цьому відбувається часткове відновлення кільця з утворенням ненасиченого гетероциклу — 2,5-дигідропіролу (піроліну). Глава 15
Поиск по сайту: |