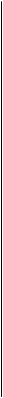|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ГІДРОКСИЛЬНІ ПОХІДНІ ВУГЛЕВОДНІВ
Гідроксильними похідними називають похідні вуглеводнів, в яких один або кілька атомів Гідрогену заміщені на гідроксильну групу. Залежно від типу гібридизації атома Карбону, безпосередньо зв'язаного з гідроксильною групою, гідроксильні похідні поділяють на спирти (гідроксильна група знаходиться при атомі Карбону в 5р3-гібридизації) та феноли (гідроксильна група розміщена при ^-гібридизованому атомі Карбону, що входить в ароматичну систему). Сполуки з гідроксильною групою при .^-гібридизованому атомі Карбону, який не входить до ароматичної системи, дістали назву еноли. Такі речовини, як правило, нестійкі. Гідроксильні похідні з групою —ОН при атомі Карбону в ^-гібридизації невідомі. Залежно від кількості гідроксильних групу молекулі розрізняють одно-, дво-, три- та поліатомні спирти і феноли. За розміщенням гідроксильної групи в карбоновому ланцюзі спирти поділяють на первинні (група —ОН розміщена при первинному атомі Карбону), вторинні (гідроксильна група розміщена при вторинному атомі Карбону) і третинні (група —ОН знаходиться при третинному атомі Карбону): Н3С.
н3с
Н3С-^С—ОН Н3С
третинний спирт ОДНОАТОМНІ СПИРТИ
Одноатомними спиртами* називаються гідроксильні похідні вуглеводнів, що містять одну гідроксильну групу, зв'язану з атомом Карбону в зр3-гі6ридизації. Відповідно до природи вуглеводневого радикала розрізняють спирти: 1) насичені(алканоли та циклоалканоли) — гідроксильні похідні алканів і циклоалканів; 2) ненасичені(алкеноли, алкіноли, циклоалкеноли та інші) — гідроксипохідні ненасичених вуглеводнів, в яких гідроксильна група не знаходиться при кратному зв'язку; 3) ароматичні(арилалканоли) — гідроксильні похідні арома НОМЕНКЛАТУРА Для спиртів найчастіше застосовують замісникову та радика-ло-функціональну номенклатуру ШРАС. За замісниковою номенклатурою назву спирту утворюють від назви вуглеводню, що відповідає головному карбоновому ланцюгу, до якого додають суфікс -ол, вказуючи положення гідроксильної групи в ланцюзі карбонових атомів. Нумерацію головного карбонового ланцюга починають з того кінця, до якого ближче розміщена гідроксильна група. Наприклад:
Н,С
н,с—сн.—он
С2Н5—ОН етиловий спирт \\ //-сн2—он бензиловий спирт Н3С-гСН2—ОН; метилкарбінол Н3С—ОН деревинний спирт
н3с. н3с-£—он н3с' /и/>е/и-бутиловий спирт н2с=сн—сн2—он
аліловий спирт
н3с—сн—сн2—он сн3
2-метил- 1-пропанол ОН
З І2 1
н3с—с—сн3 сн3 2-метил-2-пропанол
Для ненасичених спиртів структурна ізомерія може зумовлюватися й положенням кратного зв'язку:
н3с—сн=сн—сн2—он 2-бутен-1-ол З-бутен-1-ол ФІЗИЧНІ ВЛАСТИВОСТІ Насичені спирти, як правило,— безбарвні рідини або кристалічні речовини зі специфічним запахом (табл. 16.1). Нижчі члени гомологічного ряду мають характерний «спиртовий» запах; бутанолам і пентанолам притаманний неприємний «сивушний» запах; вищі алканоли мають приємний запах. Циклоалка-ноли, ненасичені та ароматичні спирти здебільшого являють собою рідкі або тверді речовини, що мають приємний, ароматний запах. Так, циклогексанол має запах камфори, пропаргіло-вий спирт (НС^С—СН2—ОН) — запах герані, а 2-фенілетанол (С6Н5—СН2—СН2—ОН) — запах троянди. Спирти мають більш високі температури плавлення та кипіння, більшу розчинність у воді, ніж відповідні вуглеводні. Така різка відмінність фізичних властивостей спиртів від алка-нів зумовлена насамперед тим, що спирти є полярними сполуками. Вони мають два полярні зв'язки С—О та О—Н. Існування на атомах гідроксильної групи часткових зарядів різного знаку приводить до міжмолекулярної взаємодії гідроксильних груп і утворення водневих зв'язків:
8+ &" т8ї
-н- -о— н
Глава 1 Таблиця 16.1 Фізичні характеристики деяких спиртів
Гідроксильні похідні вуглеводнів Унаслідок такої взаємодії відбувається асоціація молекул спирту. Водневі зв'язки значно слабші за ковалентні, однак їх утворення істотно зменшує леткість, підвищує температуру кипіння, тому що агрегати, які утворюються, мають більшу молекулярну масу. Наприклад, етан кипить при -89 °С, тоді як етанол — при 78,5 °С. Низькомолекулярні спирти добре розчинні у воді. А такі спирти, як метанол, етанол, пропаноли, аліловий та пропаргіловий, змішуються з водою в будь-яких співвідношеннях. У водних розчинах спиртів утворюються водневі зв'язки між молекулами води та спирту: 5- 5+ 5- 5+ 8- 5+ 5- 8+ • о^н ск-н • о*-н • о—н / / / / к н к н Водневі зв'язки, які утворюються, міцніїлі, ніж зв'язки між молекулами спирту, що приводить до зменшення сумарного об'єму води та спирту при змішуванні {явище контракції спирту). СПОСОБИ ДОБУВАННЯ Гідроліз галогенопохідних вуглеводнів. Галогенопохідні вуглеводнів, атом галогену яких зв'язаний з атомом Карбону в .^-гібридизації, у присутності водних розчинів лугів при нагріванні піддаються гідролізу з утворенням спиртів: Н3С—СН2—СІ Галогеналкани є електрофільними реагентами, їх електрофіль-ні властивості зумовлені полярністю зв'язку С—Наї. Оскільки атом галогену виявляє більшу електронегативність, ніж атом Карбону, електронна густина зв'язку С—Наї зміщена до атома галогену. Тому атом галогену набуває часткового негативного (8"), а атом Карбону — часткового позитивного (5+) заряду (С8+ — Наї8"). Елек-тронодефіцитний атом Карбону стає електрофільним центром молекули галогеналкану і може бути атакований нуклеофільним реагентом. У процесі атаки нуклеофіл надає пару електронів для Утворення хімічного зв'язку з електронодефіцитним атомом Карбону, а атом галогену відщеплюється від молекули галогеналкану 3 електронною парою зв'язку С—Наї:
-рС—Ш + НаГ
продукт група, заміщення що відходить Таку реакцію називають реакцією нуклеофільного заміщенаі позначають символом 5^. Нуклеофільним реагентом у реакції гідролізу виступає молекула води, тому що містить атом з неподі-леними електронними парами (НОН). Схильність галогеналканів до реакції 5^ визначається полярністю зв'язку С—Наї. Залежно від будови галогеналкану, а також природи нуклеофі-лу та розчинника реакції нуклеофільного заміщення проходять за двома механізмами: 5^1 і Зм2*. Механізм 5дг2 (бімолекулярне заміщення). За цим механізмом реакція відбувається в одну стадію з утворенням перехідного стану, у побудові якого беруть участь як молекула галогеналкану, так і нуклеофільний реагент: 8- \ /Ь-
НО С Наї
галогеналкан нуклеофіл У перехідному стані відбувається синхронний процес розриву зв'язку С—Наї і утворення зв'язку С—N11. Цифра 2 означає, що встадії, яка визначає швидкість реакції загалом (утворення перехідного стану), беруть участь два реагенти: галогеналкан і нуклеофіл. За механізмом 8Н2 легко реагують первинні, важче — вторинні галогеналкани. Механізм 5^1 (мономолекулярне заміщення). На відміну від механізму 5дг2, де розрив зв'язку С—Наї та утворення зв'язку С—N11відбуваються синхронно, у механізмі 5^1 розрив зв'язку С—Наї передує утворенню зв'язку С—№і , тобто реакція проходить у дві стадії: * Вивчається за бажанням учителя.
Стадія 2
швидко^
С + НаГ; С + N11" І і . Цей механізм називається мономолекулярним, оскільки на стадії, що визначає швидкість усього процесу (стадія 1), бере участь молекула тільки одного реагенту (галогеналкану). За механізмом §Л реагують третинні галогеналкани. Гідратація алкенів.Приєднання води до алкенів приводить до утворення насичених спиртів (див. розд. 10.6): Н2С=СН—СН3 пропен ОН 2-пропанол Оскільки приєднання води до алкенів відбувається за правилом Марковникова, то залежно від будови вуглеводню за цією реакцією утворюються вторинні і третинні спирти. З первинних спиртів цим способом можна отримати тільки етанол. Відновлення карбонільних сполук — альдегідів, кетонів, карбонових кислот.Відновлення карбонільної групи ^С=0 до гідроксильної є досить поширеним методом одержання спиртів. Як від-новлювачі використовують різні реагенти. Найчастіше вдаються до методу гідрування карбонільних сполук натрієм в етанолі. Дуже часто застосовують каталітичне гідрування в присутності нікелю Ренея, платини, паладію та ін. Крім того, для відновлення карбонільних сполук використовують комплексні гідриди металів, такі, як натрій борогідрид №+ВЩ, літій алюмогідрид ЬГАІЩ та ін.
При відновленні альдегідів, карбонових кислот утворюються первинні, а при відновленні кетонів — вторинні спирти:
~ н3с—сн2—он
^сн—он
2-пропанол
Гла Взаємодія карбонільних сполук з магнійорганічнимиспол (реактивами Гріньяра).Для здобування спиртів застосовують акцію магнійорганічних сполук КМ§Х з альдегідами, кетон та естерами. Синтез здійснюють у дві стадії. На першій с молекула магнійорганічної сполуки приєднується до моле карбонільної сполуки за місцем розриву л-зв'язку карбоніл групи. Напрямок приєднання зумовлюється полярністю нільної ^Х>=6 групи та полярністю зв'язку С—М§ у реак'
Гріньяра: К—С- о Дц Н—<ИУ + Н3С—СН2—М§Вг------ Н3С—СН2—С—ОМ Ті І н формальдегід етилмагнійбромід броммагнійалкоголят На другій стадії алкоголят, що утворився, піддають гідро у результаті якого утворюється спирт: СН3СН2СН2—ОМ§Вг + НОН —- —- сн3сн2сн2—он + м§(он 1 -пропанол Дією магнійорганічних сполук на формальдегід добува-первинні спирти, з іншими альдегідами утворюються втори спирти:
ОМ§Вг -2і х5 -Мв(ОН)Вг
оцтовий альдегід - н,с—сн,—сн—с 2 СІ он 2-бутанол Взаємодією магнійорганічних сполук з кетонами добува третинні спирти:
ОМ§Вг 9Н ■С С2Н5 _М8(ОН)Вг И3 |
н3с н сн ХІМІЧНІ ВЛАСТИВОСТІ Для спиртів характерні реакції з участю зв'язку О—Н, зв'язку С—О і реакції окиснення. Присутність у молекулі спирту кратних зв'язків або ароматичного радикала не змінює принципово хімічні властивості гідроксильної групи, а надає спиртам властивостей, характерних для ненасичених або ароматичних сполук. Кислотно-основні властивості.Спирти виявляють слабкі кислотні та слабкі основні властивості, тобто вони є амфотерними речовинами. Це пов'язано зі здатністю зв'язків О—Н і К—О до гетеролітичного розриву: К|:ОН--------- К+ + :ОН~ та К—0:|н —* КО:~ + Н+ Кислотні властивості спиртів зумовлені рухливістю атома Гідрогену гідроксильної групи. Атом Оксигену як більш електронегативного елемента змішує електронну густину зв'язку О5" —- Н5+ на себе, утворюючи при цьому на атомі Гідрогену частковий позитивний заряд. Під дією сильних основ спирти відщеплюють від гідроксильної групи протон, тобто виявляють властивості ОН-кис-лот. Проте спирти є слабшими ОН-кислотами, ніж вода. Це зумовлено позитивним індуктивним ефектом вуглеводневого радикала, зв'язаного з гідроксильною групою. Додаткове збільшення електронної густини на атомі Оксигену за рахунок +7-ефекту вуглеводневого радикала приводить до зменшення полярності зв'язку ^ Н і відповідно рухливості атома Гідрогену. Тому при переході Від первинних спиртів до третинних кислотні властивості знижуються: 5+
н—о—н > н3с—о—н > > п^сн~о~н> н3Ь$с-о-н 8+ > 5+ > 5+ > 6+ Н,С Н3СГ
Глава 1Л Спирти як кислоти реагують з лужними металами, утворюючи алкоголяти (алкоксиди):
- 2С2Н5—0~Н+ + НЛ Алкоголяти легко розкладаються водою до вихідних спиртів. Це підтверджує, що спирти є більш слабкими кислотами, ніж вода;
С2Н5—СГКа+ + НОН Через низьку кислотність спирти майже не вступають в реакцію з лугами. Основні властивості спиртів зумовлені наявністю на атомі Ок-сигену гідроксильної групи неподіленої пари електронів, здатної до приєднання протону. Так, із сильними кислотами первинні спирти утворюють на холоді нестійкі солі алкілоксонію:
С2Н5—ОН+ НВг етилоксоній бромід У багатьох реакціях з участю спиртів алкоксонієві солі утворюються як проміжні продукти. Порівняно з кислотними основні властивості спиртів змінюються в протилежному порядку, тобто при переході від первинних до третинних спиртів основні властивості зростають:
нзСх 8-
< ^СН—О—Н Н3С б- < 8і- < 8- Взаємодія з мінеральними та органічними кислотами.Спирти реагують з мінеральними кислотами (сульфатною, нітратною та ін.) та органічними кислотами з утворенням складних ефірів (ес-терів). Ця реакція дістала назву реакції естерифікації(етерифікації) (від лат. аеіНег — етер):
с2н5—он-н + но-Ио,н гілроксильні похідні вуглеводнів_____________________________ 22з с н5—°4н + но-)-но2 *=— с2н5—оио2 + н2о етилнітрат ............................ .................................... ТЛ СЛ сН5_оч-н + но)-с—сн3 *=& с2н5—о—с—сн3 + н2о в г\ о ° етилацетат Реакція естерифікації оборотна. Для зміщення рівноваги вправо або беруть надлишок одного з реагентів (часто спирту), або видаляють один з продуктів реакції. Взаємодія спиртів з карбоновими кислотами відбувається в присутності каталізатора, найчастіше використовують концентровану Н2804. Швидкість реакції естерифікації залежить від будови спирту і карбонової кислоти. Молекула води, яка виділяється в процесі взаємодії, утворюється за рахунок атома Гідрогену групи —ОН спирту та гідроксильної групи карбонової кислоти: О 1 ,................. Н2504к0НІІ ^ ьі—с-юн + ню—к Дегідратація спиртів.При нагріванні спиртів у присутності концентрованої сульфатної кислоти, безводної фосфатної кислоти або при пропусканні парів спирту над каталізатором — алюміній оксидом (А1203) — спирти відщеплюють воду, тобто піддаються дегідратації. Залежно від природи спирту та умов проведення реакція дегідратації може відбуватись міжмолекулярно і внугрішньомоле- кулярно. При міжмолекулярній дегідратації спиртів утворюються прості ефіри {е/пери): С2Н5—О-І-Н + НО-М^Нз діетиловий етер Шляхом внутрішньомолекулярної дегідратації утворюються алкени: Н3С—СН2—ОН етилен При цьому, якщо з атомом Карбону, який несе гідроксильну ^Упу, безпосередньо зв'язані нерівноцінні атоми Карбону, від-
-сн3 Н 3С С Н 2 С гГ 2-бутанол ОН 2-бутен Міжмолекулярна та внутрішньомолекулярна дегідратації спиртів являють собою два конкуруючі процеси, кожний з яких за певних умов може стати домінуючим. Відщеплення води від двох молекул спирту з утворенням простих ефірів (етерів) — міжмолекулярна дегідратація — стає переважним процесом при нагріванні спиртів у присутності каталітичних кількостей мінеральної кислоти (спирт у надлишку) при температурі 140—160 °С. Внутрішньомолекулярна дегідратація, тобто перетворення спирту на алкен, стає домінуючою при нагріванні спиртів з надлишком мінеральної кислоти при температурі вище 170 °С. Особливо легко вона відбувається в третинних спиртів. У випадку пропускання парів спирту над А1203 при температурі 200—250 °С відбувається міжмолекулярна дегідратація з утворенням простих ефірів (етерів), а за більш високих температур (300—400 °С) відбувається внутрішньомолекулярна дегідратація, тобто утворюються алкени. Внутрішньомолекулярна дегідратація спиртів належить до реакцій елімінування (відщеплення) (£)*. Залежно від будови спирту елімінування може відбуватися за механізмами Е\ і Е2. При цьому первинні спирти реагують переважно за механізмом Е1, а вторинні і особливо третинні — за механізмом Ш. Як і у випадку нуклео-фільного заміщення, елімінування спиртів відбувається з утворенням оксонієвого катіона. Нижче наведено схему внутрішньомолекуляр-ної дегідратації за механізмом Е\: н к н к II І І +/н а—с—с—он + н+ -—. к—с—с—о( ~-—
II І І \.- -н'°
к—с=с: алкен Гідроксильні похідні вуглеводнів___________________________ Взаємодія з галогеноводневими кислотами. При взаємодії спиртів з галогеноводневими кислотами (НС1, НВг, НІ) гідроксильна група замішується на атом галогену і утворюються галогеналкани. Реакція є оборотною. Для зміщення рівноваги вправо, як правило з реакційного середовища відганяють воду або галогеналкан: С2Н5—ОН + НІ — С2Н5—І + Н20 За реакційною здатністю зі спиртами галогеноводневі кислоти розташовуються в ряд: НС1 < НВг < НІ. З йодидною та бромід-ною кислотами реакція проходить легко, з хлоридною — значно важче. Первинні та вторинні спирти реагують з хлоридною кислотою тільки в присутності цинк хлориду (кислота Льюїса). Реакційна здатність спиртів у відношенні до галогеноводневих кислот зменшується в ряду:
третинні вторинні первинні спирти спирти спирти З первинними спиртами реакція проходить, як правило, за механізмом 5М2, з третинними — за 5^1. Вторинні спирти реагують за механізмами як 5>1, так і 8М2. Нижче подано схеми взаємодії спиртів з бромоводневою кислотою за механізмами 5И2 і 5^1. Механізм 5ьґ2
/ Вг"
^ Н3С-СН2-Вг
брометан
н3с
Н,С—С—Вг к</ Чн"Н2° н3(/ н3с/
2-метил-2-пропанол оксонієвии іон карбокатіон 2-бром-2-метилпропан Органічна хімія
Глава 16 Взаємодія з галогенангідридами неорганічних кислот (РС13, РВг3, РС15, 80С12). При дії на спирти галогенідів фосфору РС13, РВг3, РС15 та тіонілхлориду 80С12 утворюються галогеналкани:
ЗС,Но- Вг + НяРО,
'2ІХ5брометан
с2н5—сі + неї + росіз - с2н5—сі + нсН + 80,1 С,Н,—ОН + 80С1, Окиснення. Первинні, вторинні та третинні спирти по-різному реагують на дію окисників. Первинні спирти при окисненні спочатку утворюють альдегіди, які можуть окиснюватись далі, перетворюючись при цьому на карбонові кислоти:
Н,С—СН,—ОН + СиО
етанол
[О]
н3с—сн2—сн2-
1-пропанол
Н3С- "ОН
пропанова кислота Вторинні спирти при окисненні утворюють кетони: [О]
Н3С—СН-
I2-пропанол ОН Третинні спирти стійкі до окиснення, проте за жорстких умов вони окиснюються з розривом карбонового скелета молекули та утворенням суміші кетонів і карбонових кислот. Як окисники для окиснення спиртів використовують купрум (II) оксид, хром (VI) оксид, калій дихромат в сульфатній кислоті (хромова суміш), калій перманганат у сульфатній кислоті та ін. У промисловості для окиснення первинних спиртів в альдегіди вдаються до методу каталітичного дегідрування. Суть методу полягає в пропусканні парів спирту над каталізатором (тонкоздріб-нена мідь) при 280—300 °С. При цьому відбувається відщеплення молекули водню від молекули спирту, і утворюється альдегід. Пе-
Гідроксильні похідні вуглеводнів_________________________________ оевагою каталітичного гідрування є те, що тут не відбувається більш глибоке окиснення альдегіду — до кислоти: н3с-сн2-он \н За цією реакцією із вторинних спиртів синтезують кетони. ІДЕНТИФІКАЦІЯ СПИРТІВ Хімічні методи. Для спиртів не існує якісної реакції, яка б переконливо і однозначно вказувала на наявність у молекулі гідроксильної групи. Спирти можна розрізнити за їх реакцією окиснення хром (VI) оксидом Сг03 у водному розчині Н2804. Приблизно протягом двох секунд прозорий оранжевий розчин перетворюється на каламутний блакитнувато-зелений. Проте цієї реакції не дають третинні спирти. Ця реакція характерна також для альдегідів, але їх можна відрізнити від спиртів іншими специфічними реакціями. Для ідентифікації спиртів придатна і реакція утворення естерів К—СО—ОК.', які зазвичай мають характерний приємний запах. Для визначення того, є спирт первинним, вторинним чи третинним, роблять пробу Лукаса. Вона ґрунтується на різній швидкості взаємодії первинних, вторинних і третинних спиртів з розчином цинк хлориду в концентрованій хлоридній кислоті (реактив Лукаса). Так утворюється галогенопохідне вуглеводню, яке виділяється у вигляді дрібнодисперсного осаду. Взаємодіючи з реактивом Лукаса, третинні спирти виявляються майже одразу, вторинні — приблизно за п'ять хвилин, а первинні спирти при кімнатній температурі практично не реагують. Спирти, що мають у молекулі фрагмент —СН(ОН)СН3, дають позитивну йодоформну пробу. Вона полягає в обробці спирту йодом та натрій гідроксидом або натрій гіпойодитом №01. Унаслідок реакції утворюється жовтий осад йодоформу (СНІ3), який має характерний запах. ? &—С—СН3 + №01----- К—С—СН3 + №1 + Н20 (окиснення) он о К—С—СН3 + 3№ОІ-------------- К—С—СІ3 + 3№ОН (заміщення) О о 8*
- СНІзі + К—СОО~№+ йодоформ (жовтий осад) Йодоформна проба не є суто специфічною реакцією на спирти. Позитивну йодоформну пробу також дають інші сполуки, що1 містять у своїх молекулах фрагмент X Сн, ОКРЕМІ ПРЕДСТАВНИКИ Метанол СН3ОН.Безбарвна горюча рідина із запахом, що на гадує запах етилового спирту, змішується з водою в будь-яких спі] відношеннях (т. кип. 64,7 °С). Отруйний, смертельна доза при вживанні — 25 г, менші кількості призводять до сліпоти. При окисне* в організмі метанол перетворюється на формальдегід і мураш* кислоту. Має значення як вихідна сполука для синтезу органіч речовин, використовується в ролі розчинника. До 1925 року метанол здобували сухою перегонкою деревини. Зараз його добував каталітичним гідруванням карбон (II) оксиду. Вихідною сировиною є синтез-газ — суміш карбон (II) окс* з воднем (1:2) при наявності каталізаторів (хром (III)оксиду і: оксиду). Синтез-газ при температурі 380—420 °С і тиску 25 МПа пе{ творюється каталітично в метанол: СО + 2Н2 ^^ СН3ОН + 0 Реакція утворення метанолу оборотна, тому для зміщення рівноваги вправо застосовують принцип Ле-Шательє. Особливості технологічного процесу: при проходженні газової суміші крізь шар каталізатора утворюється 10—15 % метанолу, який конденсують, а суміш, яка не прореагувала, змішують із свіжою порцією синтез-газу і після нагрівання знов направляють у шар каталізатора (циркуляція). При цьому загальний вихід метанолу складає 85 %. Зважаючи на те, що синтез метанолу при середньому тиску схожий із синтезом амоніаку з природного газу, часто їх виробництво поєднують (азотно-тукові заводи). Як ми вже знаємо, у процесі взаємодії метану (природного газу) з водяною парою при високій температурі утворюється синтез-газ: СН4 + Н20 -=- СО + ЗН2 З'ясуємо умови, які будуть оптимальними для промислового здійснення синтезу метанолу. Реакція відбувається зі зменшенням об'єму суміші, тому зміщенню рівноваги в бік утворення потрібного продукту сприятиме підвищення тиску. Для того, щоб реакція проходила з достатньою швидкістю, необхідні каталізатор і підвищення температури. Але в данному випадку реакція екзотермічна, тому сильне нагрівання призведе до прискорення реакції, що відбувається з поглинанням тепла, тобто до розкладення спирту, який утворюється. З'ясувавши наукове підґрунтя процесу, можемо тепер розглянути його технологію (рис. 16.1). Синтез-газ стискують компресором, змішують з газом, який не прореагував, і спрямовують у теплообмінник, де газова суміш нагрівається до потрібної температури газами, що відходять. Далі суміш газів надходить у колону синтезу, де здійснюється основний процес. Продукти реакції, які виходять з колони синтезу, надходять у теплообмінник, де вони нагрівають газову суміш, що йде на синтез, потім проходять через холодильник-конденсатор і надходять у сепаратор. Тут метанол відокремлюється від газів, які не прореагували і циркуляційним компресором повернуті в технологічний процес.
Рис. 16.1. Схема промислового добування метанолу: ' ~— турбокомпресор; 2 — теплообмінник; 3 — колона синтезу; 4 — холодильник-конденсатор; 5 — сепаратор; 6 — збірник метанолу
Глава 16 Колони синтезу бувають різної конструкції: звичайно використовують подібні за будовою до колон синтезу амоніаку (згадайте, як вони працюють). Легко помітити, що в технологічних схемах синтезу амоніаку і метилового спирту багато спільного. Проте є істотні відмінності в перебігу процесів. Під час синтезу метилового спирту, на відміну від амоніаку, відбуваються побічні реакції, у результаті яких можливе утворення багатьох побічних продуктів: спиртів більшої молекулярної маси, диметилового та інших етерів, вуглеводнів і т. ін. Тому висуваються високі вимоги до відбору каталізаторів. Тут необхідні селективні каталізатори (лат. зеїесіїо — вибір), які прискорювали б основну реакцію і пригнічували інші можливі процеси. Такі властивості притаманні згаданим каталізаторам. Етанол С2Н5ОН.Безбарвна горюча рідина, пекуча на смак, з характерним запахом, змішується з водою в будь-яких співвідношеннях (т. кип. 78,3 °С). Летальна доза коливається (звичайно близько 300 г). У невеликих кількостях викликає сп'яніння, великі дози спричиняють наркотичний стан. В організмі окиснюється до оцтового альдегіду і згодом — до вуглекислого газу та води. Широко використовується як сировина та розчинник в органічному синтезі, у фармації та медицині (виготовлення настоянок, екстрактів, розчинів), як знезаражуючий засіб, для консервації анатомічних препаратів, як пальне тощо. Входить до складу алкогольних напоїв. Для здобування етанолу широко застосовується ферментативний гідроліз вуглеводів: СйН„Ол
'б1112^6 глюкоза
Але поряд із цим методом етанол одержують також реакцією гідратації етену:
Н,с—сн,—он Гідроксильні похідні вуглеводнів
(С2Н5ОН + Н20) + СаО азеотропна суміш
Поиск по сайту: |





 щеплення води відбувається за правилом Зайцева, тобто Гідроген відходить від сусіднього, менш гідрогенізованого атома Карбону:
щеплення води відбувається за правилом Зайцева, тобто Гідроген відходить від сусіднього, менш гідрогенізованого атома Карбону: * Вивчається за бажанням учителя.
* Вивчається за бажанням учителя.