 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ПРЕДСТАВНИКИ БАГАТОЯДЕРНИХ АРЕНІВ
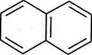
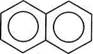
Найважливішими представниками конденсованих аренів є на фтален, антрацен і фенантрен. НАФТАЛЕН Уперше нафтален було виділено з кам'яновугільної смол в 1819 році. Елементний склад його молекули встановив російський хімік О. А. Воскресенський 1838 року, а будову довів німецький хімік К. Гребе 1898 року. Фізичні властивості.Нафтален — безбарвна тверда речовина з характерним запахом, виявляє високу леткість (т. пл. 80,3 °С). Добре розчиняється в органічних розчинниках, погано — у воді. Нафтален використовують у виробництві фталевого ангідриду, тетраліну, декаліну, барвників, лікарських засобів. Застосовується як інсектицид. Нафтален, його монометильні та деякі похідні в промисловості отримують звичайно з кам'яновугільної смоли (вміст нафталену в кам'яновугільній смолі становить близько 10 %) або синтетично—з ацетилену, пропускаючи його через нагріті трубки (700— 800 °С) з активованим вугіллям. При цьому утворюється суміш бензену та нафталену.
5НС=СН •/>:>'
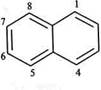
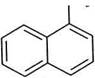
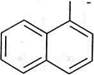
Слід зазначити, що в молекулі нафталену, на відміну від бензену, атоми Карбону нерівнозначні. Атоми Карбону в положеннях 1, 4, 5, 8 відрізняються від атомів Карбону в положеннях 2, 3, 6, 7. Зважаючи на це, чотири рівнозначні положення в молекулі нафталену — 1, 4, 5, 8 — прийнято позначати літерою а й називати а-положенням, а чотири інші рівнозначні між собою положення — 2, 3, 6, 7 — позначати літерою Р і називати Р-положення. Унаслідок нерівнозначності положень однозаміщені нафтале-ни існують у вигляді двох ізомерів — а- та Р-:
а-метилнафтален, 1 -метилнафтален
Будова нафталену.Електронна будова нафталену схожа з будовою бензену. Аналогічно бензену молекула нафталену планарна (плоска). Усі атоми Карбону знаходяться в $р2-гібридизації. Кожний з десяти атомів Карбону надає /?-атомну орбіталь для утворення замкненої спряженої системи, яка охоплює всі атоми Карбону (рис. 13.3). Загальна кількість я-електронів (10е~) у спряженій системі відповідає правилу ароматичності Хюккеля (див. розд. 13.1). Проте ступінь ароматичності в нафталену нижчий, ніж у бензену. Тому нафтален легший за бензен, вступає в реакції заміщення, приєднання, окиснення та відновлення. Для зображення молекули нафталену в хімічній літературі застосовують структурні формули: Ненасичені вуглеводні. Глава із
Хімічні властивості.Для нафталену, як і для бензену, характерні реакції електрофільного заміщення, приєднання, відновлення та окиснення. Окиснення супроводжується утворенням фталевого ангідриду:
О
Ю]у205
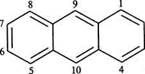
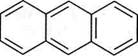
АНТРАЦЕН Молекула антрацену складається з трьох лінійно конденсованих бензенових циклів. Нумерацію атомів Карбону виконують як показано на структурній формулі (нумеруються лише атоми Карбону, які несуть Гідроген):
Рис. 13.3. Схема утворення замкненої л-електронної системи в молекулі нафталену Нітрування ($е). Нафтален досить легко нітрується нітруючо сумішшю з утворенням а-нітронафталену:
+ н>ю, а-нітронафтален Відновлення (реакція приєднання). У присутності каталізатора (№) нафтален значно легше за бензен приєднує водень. Процес гідрування нафталену відбувається ступінчасто. Спочатку при температурі 150 °С утворюється 1,2,3,4-тетрагідронафтален (тетралін), який при 200 °С гідрується далі з утворенням декагідронафталену (декаліну):
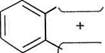
Н2/Мі 150 °С Положення 1, 4, 5, 8 у молекулі антрацену називають а-поло-женням, 2, 3, 6, 7 — (3-положенням, а 9 і 10 — у- або м- (мезо — середній) положеннями. Молекула антрацену плоска. Усі атоми Карбону знаходяться в 5р2-гібридизації. Кількість тс-електронів (140 відповідає правилу Хюккеля. Але електронна густина в молекулі розподілена ще більш нерівномірно, ніж у нафталену. Антрацен вперше було виділено з кам'яновугільної смоли в 1832 році французькими хіміками Ж. Дюма та О. Лораном. У лабораторних умовах антрацен можна здобути реакцією Фріделя—Крафтса, виходячи з бензену і 1,1,2,2-тетраброметану:
Н ВН-СН-нВг Н) Фізичні властивості.Антрацен — прозора кристалічна речовина, т. пл. 217-°С, розчинна в бензені, етерах; нерозчинна у воді. Ненасичені вуглеводні. Глава 13
Хімічні властивості.Антрацен, на відміну від бензену і нафта-лену має менш виражену ароматичність, а тому для нього більш. характерні реакції приєднання. Відновлення:
ГЛАВА
ГЛАВА
N1 ■
Н н пергідроантрацен
[О] нїчо3 *А 9,10-антрахінон Антрацен широко використовується для виробництва барвників.
Поиск по сайту: |
 СН,
СН,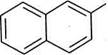 сн,
сн,






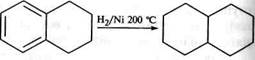
 [лТІІгт-СН-ІВґ Щ
[лТІІгт-СН-ІВґ Щ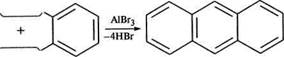



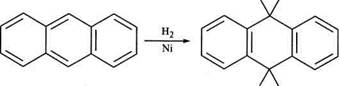
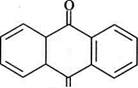 Окиснення антрацену нітратною кислотою або хромовою сумішшю супроводжується утворенням жовтої кристалічної речовини — антрахінону:
Окиснення антрацену нітратною кислотою або хромовою сумішшю супроводжується утворенням жовтої кристалічної речовини — антрахінону: