 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
СИНТЕТИЧНІ МЕТОДИ ДОБУВАННЯ. Циклотримеризація алкінів
Циклотримеризація алкінів. При нагріванні в присутності комплексних нікельорганічних каталізаторів алкіни утворюють бензен і його гомологи (див. розд. 12.5). Одноядерні арени__________________________________ __—------------------------------------------------------------------------------------------ 155
| + 2Иа + Вг—С2Н5---------- || і + 2№Вг бромобензен брометан етилбензен Ця реакція є окремим випадком реакції Вюрца стосовно аренів (див. розд. 8.4.2). Побічними продуктами в реакції Вюрца— фіттіга є алкани, а також дифеніл і його гомологи: 2С6Н5Вг + 2Ка ------- * (^ у- <( )> + 2№Вг дифеніл 2С2Н5Вг + 2Иа---------- СН3СН2СН2СН3 + 2ИаВг бутан Алкілування ароматичних вуглеводнів за Фріделем—Крафтсом. Реакція Фріделя—Крафтса (1837 р.) є загальним методом добування гомологів бензену. Вона ґрунтується на взаємодії ароматичних вуглеводнів з алкілуючими реагентами — галогеналканами, алкенами або спиртами (див. розд. 13.5.1). Сплавляння солей карбонових кислот з лугами: С6Н5(СОСЖа Т^аОіН----- -—- С6Н6 + N33003 натрій бензоат ФІЗИЧНІ ВЛАСТИВОСТІ За звичайних умов бензен і нижчі члени гомологічного ряду — Рідини, що мають сильний специфічний запах (табл. 13.1). Усі ароматичні вуглеводні нерозчинні у воді і добре розчиняються в органічних розчинниках. Багато з них самі є розчинниками для інших органічних речовин. Через високий вміст Карбону ароматичні вуглеводні горять сильно кіптявим полум'ям. Бензен дуже отруйний. Тривале вдихання його парів спричиняє захворювання на лейкемію. Ненасичені вуглеводні. Глава / Рдноядерні арени — 157
ХІМІЧНІ ВЛАСТИВОСТІ Реакційна здатність бензену і його гомологів визначається переважно наявністю в структурі замкнутої л-електронної системи, яка є областю підвищеної електронної густини молекули і здатна притягувати позитивно заряджені частинки — електрофіли. Тому ароматичні вуглеводні, як і алкени, мають нуклеофільний характер. Проте арени, на відміну від ненасичених сполук, при взаємодії з електрофільними реагентами більш схильні не до реакцій приєднання, а до реакцій заміщення, оскільки при цьому зберігається їх ароматична система. Ці реакції називають реакціями електрофільного заміщення (З^). Реакції приєднання, які призводять до порушення ароматичності, для аренів менш характерні. Дуже важко ароматичні вуглеводні вступають у реакції окиснення. 13.5.1. РЕАКЦІЇ ЕЛЕКТРОФІЛЬНОГО ЗАМІЩЕННЯ (5£) Бензен і його гомологи порівняно легко вступають у реакції електрофільного заміщення. Електрофільна частинка, що атакує л-електронну систему бензенового кільця, може являти собою позитивно заряджений іон Е+ або частину нейтральної молекули, яка має центр зі зменшеною електронною густиною Е5+ — X -Утворення електрофільних частинок для участі в реакції можливе різними способами — під дією л-електронної системи бензенового кільця, каталізатора, розчинника та ін. Незважаючи на велике різноманіття електрофільних реагентів ароматичних систем, переважна більшість реакцій електрофільного заміщення в ароматичному ряду відбувається за єдиним механізмом.
+ Е+ л-комплекс л-Комплекс являє собою координаційну сполуку, в якій бен-зенове кільце є донором електронів, а електрофіл — акцептором. Утворення л-комплексу — це швидка і оборотна стадія реакції. Ароматичність бензенового кільця при цьому не порушується. Вбираючи деяку кількість енергії, л-комплекс перетворюється потім на 0-комплекс (карбокатіон). На відміну від л-комплексу, в а-комплексі електрофільна частинка утворює ковалентний зв'язок з одним із атомів Карбону бензенового кільця за рахунок двох його л-електронів. При цьому відбувається порушення ароматичної системи бензенового циклу, один з атомів Карбону переходить зі стану 5/?2-гібридизації в зр -гібридний стан. Чотири л-електрони бензенового кільця, що залишилися, делокалізовані поміж п'ятьма атомами Карбону.
Будову о-комплексу можна зобразити у вигляді резонансного гібрида структур І, II та III, але частіше його зображують структурою IV:
Ненасичені вуглеводні. Глава 13 рдноядерні арени
-Н+ ^^ Відновлення ароматичної структури дає виграш енергії, що дорівнює 42 кДж/моль. До найважливіших реакцій електрофільного заміщення в бен-зеновому ядрі належать реакції нітрування, галогенування, сульфування, алкілування і ацилування.
+ нт Атакуючою електрофільною частинкою в реакції нітрування є іон нітронію N0^, який утворюється в результаті кислотно-основної реакції між нітратною та сульфатною кислотами, де нітратна кислота відіграє роль основи (пригадайте теорію Бренстеда):
Н—6—К02 + Н804 Н протонована нітратна кислота
Н20 + N0^
нітроній-іон
Н30+ + Н504 Сумарне рівняння має такий вигляд: Н^3 + 2Н2304 ------ -Ж)£ + Н30+ + 2Н804
+ N0^ ст-комплекс Сульфування.Це процес заміщення атома Гідрогену в бензе-новому ядрі на сульфогрупу —803Н. Для сульфування бензену та його гомологів використовують переважно концентровану сульфатну кислоту або димлячу сульфатну кислоту (олеум). Під час взаємодії утворюються аренсуль-фокислоти: 50,Н
Ґ""4) бензенсульфокислота Сульфування аренів є оборотною реакцією. Вода, яка утворюється в процесі взаємодії, змішує рівновагу вліво. Тому для збільшення виходу цільового продукту беруть надлишок концентрованої сульфатної кислоти або використовують олеум (розчин сульфур триоксиду 803 у сульфатній кислоті).
Ненасичені вуглеводні. Глава ппноядер"1 арени
^Ч,
+ Вг—Вг^РеВг,
,/"4, + ЗС1, РеСЬ -н+ СІ гексахлоробензен
гГ"^ + С2Н5С1 хлоретан етилбензен
■ етилбензен Н3С—СН—СН3
О О Органічна хімія Ненасичені вуглеводні. Глава 1 0/1НОЯДЄРНІ аРени
Утворення електрофілу з галогеналканів: С,Щ + А1С1;
С2Н5—СІ + А1С13 * хлоретан
Утворення електрофілу з алкенів: св, + н+»- і2 т аі "•------------ ±±3\_ \^іі \^іі3 За механізмом реакція алкілування аналогічна розглянутим! реакціям нітрування, сульфування та галогенування:
г^ч
Ч^ Зупинити реакцію на стадії утворення продуктів часткового гідрування (циклогексадієну, циклогексену) неможливо, оскільки останні гідруються значно легше за самий бензен. Хлорування.При інтенсивному сонячному світлі або під дією ультрафіолетового випромінювання бензен приєднує хлор. Реакція проходить за радикальним механізмом, з утворенням гекса-хлороциклогексану (гексахлорану), який використовують як засіб для знищення комах:
Ч^
Завдяки електронодонорним властивостям алкільної групи утворений у процесі алкілування продукт більш схильний до взаємодії з електрофілом, ніж вихідний арен. Тому процес алкілування час- \ то не припиняється на стадії утворення монозаміщеного продукту, а триває, утворюючи ди- та поліалкіларени.
РЕАКЦІЇ ПРИЄДНАННЯ Як зазначалося раніше, реакції приєднання для ароматичних вуглеводнів не є характерними. Проте за жорстких умов вони все ж таки відбуваються. Гідрування.При підвищених температурі та тиску в присутності каталізаторів, з яких найчастіше використовують дрібнопорис-тий нікель (нікель Ренея), бензен і його гомологи приєднують три молекули водню, утворюючи циклогексан та його похідні: N1 + ЗН,
циклогексан РЕАКЦІЇ ОКИСНЕННЯ Окиснення бензенового циклу.Бензенове кільце дуже стійке до дії окисників. За звичайних умов такі сильні окисники, як калій перманганат, нітратна кислота, хром (VI) оксид, гідроген перок-сид та інші, не окиснюють бензен. Але за жорстких умов, наприклад при дії кисню повітря в присутності ванадій (V) оксиду як каталізатора і при температурі 400—500 °С, бензенове ядро окис-нюється, утворюючи малеїновий ангідрид:
Р
Ч^ О малеїновий ангідрид ■ Окиснення гомологів бензену.Алкілбензени, на відміну від не-заміщеного бензену, окиснюються значно легше. У цьому випадку при дії сильних окисників (КМп04, К2Сг207 та інші) піддаються окисненню бокові ланцюги. Продуктами окиснення є ароматичні Карбонові кислоти. Причому, кожний алкільний радикал у бензе-Новому кільці, незалежно від довжини карбонового ланцюга, окислюється в карбоксильну групу: б»
Ненасичені вуглеводні. Глава М
+ Н,0+ СО,
хюон фталева кислота о-етилтолуен Окиснення алкілбензенів є важливим способом добування ароматичних карбонових кислот.
Поиск по сайту: |
 Взаємодія суміші алкіл- і арилгалогенідів з металічним натрієм (реакція Вюрца—Фіттіга). При обробці металічним натрієм суміші галогеналканів і галогенаренів утворюються гомологи бензену:
Взаємодія суміші алкіл- і арилгалогенідів з металічним натрієм (реакція Вюрца—Фіттіга). При обробці металічним натрієм суміші галогеналканів і галогенаренів утворюються гомологи бензену: Таблиця 13. Деякі фізичні константи нижчих гомологів бензену
Таблиця 13. Деякі фізичні константи нижчих гомологів бензену
 Під час атаки електрофільного частинкою л-електронної системи бензенового кільця спочатку внаслідок електростатичної взаємодії утворюється нестійкий л-комплекс:
Під час атаки електрофільного частинкою л-електронної системи бензенового кільця спочатку внаслідок електростатичної взаємодії утворюється нестійкий л-комплекс:

 Утворення с-комплексу є найбільш високоенергетичною стадією реакції, яка визначає швидкість усього процесу.
Утворення с-комплексу є найбільш високоенергетичною стадією реакції, яка визначає швидкість усього процесу.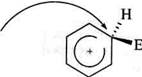 Незважаючи на відносну стабільність ст-комплексу за рахунок розподілу позитивного заряду поміж п'ятьма атомами Карбону, він значно менш стійкий, ніж структури з ароматичним секстетом електронів. Для того, щоб набути більшої стабільності, ст-комплекс відщеплює протон від атома Карбону, зв'язаного з електрофілом, і тим самим відновлює ароматичність бензенового кільця:
Незважаючи на відносну стабільність ст-комплексу за рахунок розподілу позитивного заряду поміж п'ятьма атомами Карбону, він значно менш стійкий, ніж структури з ароматичним секстетом електронів. Для того, щоб набути більшої стабільності, ст-комплекс відщеплює протон від атома Карбону, зв'язаного з електрофілом, і тим самим відновлює ароматичність бензенового кільця:
 Нітрування.Це процес заміщення атома Гідрогену в бензено-вому ядрі на нітрогрупу —Ж)2. Як нітруючі реагенти в реакції нітрування здебільшого використовують концентровану нітратну (азотну) кислоту або суміш концентрованих нітратної та сульфатної кислот {нітруювальна суміш). З концентрованою нітратною кислотою бензен і його гомологи реагують повільно. Тому для нітрування аренів переважно використовують нітрувальну суміш:
Нітрування.Це процес заміщення атома Гідрогену в бензено-вому ядрі на нітрогрупу —Ж)2. Як нітруючі реагенти в реакції нітрування здебільшого використовують концентровану нітратну (азотну) кислоту або суміш концентрованих нітратної та сульфатної кислот {нітруювальна суміш). З концентрованою нітратною кислотою бензен і його гомологи реагують повільно. Тому для нітрування аренів переважно використовують нітрувальну суміш:
 Іон нітронію атакує гс-електронну систему бензенового ядра, утворюючи нітропохідне:
Іон нітронію атакує гс-електронну систему бензенового ядра, утворюючи нітропохідне:




 Окрім галогеналканів, для алкілування аренів придатні алкени. Алкілування аренів алкенами вимагає присутності каталізаторів — кислот Льюїса — та мінеральної кислоти в ролі джерела протонів:
Окрім галогеналканів, для алкілування аренів придатні алкени. Алкілування аренів алкенами вимагає присутності каталізаторів — кислот Льюїса — та мінеральної кислоти в ролі джерела протонів:
 Атакуючою електрофільною частинкою в реакції алкілуванні за Фріделем—Крафтсом є карбокатіон, який утворюється в кожному конкретному випадку при взаємодії алкілуючого реагенту! і каталізатора.
Атакуючою електрофільною частинкою в реакції алкілуванні за Фріделем—Крафтсом є карбокатіон, який утворюється в кожному конкретному випадку при взаємодії алкілуючого реагенту! і каталізатора. СІ
СІ



 соон
соон + Н20
+ Н20