|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
а-терпінеол; і-ментен-8-ол⇐ ПредыдущаяСтр 163 из 163
Р-тершнеол; 8-ментен-і-ол Найбільш розповсюджений у рослинах а-терпінеол містить один асиметричний атом Карбону, через що існує в двох енантіомерних формах, представлених у складі різних олій: геранієвої — (±)-форма, камфорної — (-)-форма, скипидару — (+)-форма. Терпінеоли — низькоплавкі кристалічні речовини з запахом бузку, що зумовило їх застосування в парфумерії. Біциклічні терпени. В основі будови молекул терпеноїдів цієї групи виступають чотири найважливіших представники циклічних терпенових вуглеводнів — пінан, камфан (борнан), каран і туйан (сабінан):
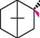
пінан; камфан; борнан; Триметил- 1,7,7-триметил- біцикло[3.1.1]гептан біцикло[2.2.1]гептан каран; 3,7,7-триметил-біцикло[4.1.0]гептан туйан; сабінан; 1-ізопрошл-4-метил-біцикло[3.1.0]гексан Частіше від інших похідних цієї групи терпенів у природі зустрічається а-пінен1.
Глава 37
Сн,
а-Пінен міститься в різних ефірних оліях, але найбільша його кількість знаходиться в терпентинній олії — скипидарі (до 75 %). Добувають скипидар перегонкою з водяною парою живиці, яка виділяється при надрізах кори («підсочування») хвойних дерев, переважно сосни. Залишок, який не переганяється,— це суміш смоляних кислот складу C19H29COOH, її називають каніфоллю. Молекула а-шнену має оптичну активність і містить два асиметричних центри. Склад терпентинної олії різний і залежить від ботанічного виду рослини. Може переважати лівообертаючий а-шнен із сосни приморської (Ріпш ріпазіег) і право-обертаючий — із сосни лісової (Ріпш зуЬезігіз). При нагріванні з розведеними мінеральними кислотами (нітратною, сульфатною) а-шнен перетворюється в а-тершнеол і терпін.
ОН" нон
ОН а-пінен а-терпшеал терпін При витримуванні на повітрі пінен і скипидар окиснюються киснем з утворенням пероксиду, який можна виявити за його окисними властивостями (по відношенню, наприклад, до HI). Потім пероксид перетворюється в кетон групи пінану — вербенон, що міститься в деяких ефірних оліях.
Пінен і відповідно скипидар широко використовуються як роз з жирів (оліфи). Пінен використовують також як вихідну речовину для одержання синтетичної камфори. Скипидар часто застосовують для втирання в шкіру як подразнюючий, знеболюючий і антисептичний засоби. Спиртом борнанового (камфанового) ряду є борнеол (борніловий спирт, або 2-камфанол).
ОН он ЛІПІДи Він має три асиметричних атоми Карбону в молекулі, і тому оптичні ізомери в нього представлені, крім енантіомерів, парою діастереомерів — борнеолом і ізо-борнеолом. При кип'ятінні з металічним натрієм у ксилені борнеол і ізоборнеол перетворюються один в одного.
а-пінен + н—о—с—к о карбонова кислота О—с—к естер борнеолу Борнеоли — це безбарвні кристалічні речовини зі специфічним «камфорно-хвойним» запахом, розчинні в спиртах і етері, практично нерозчинні у воді. Сублімуються нижче температури плавлення. Борнеоли виявляють хімічні властивості вторинних спиртів. При окисненні хроматною кислотою H2CrО4 утворюють кетон — камфору.
ОН [ ]
О борнеол Під дією кислот борнеоли (особливо ізоборнеол) легко відщепляють воду і перетворюються в камфен. Реакція проходить через стадію перегрупування борніл-катіона, що утворюється, в ізоборніл-катіон.
борнеол борніл-катіон ізоборніл-катіон камфен Здобутий камфен здатний гідратуватися в кислому середовищі з утворенням ізоборнеолу.
камфен Н2О; Н НО ОН
ізоборнеол Глава 37 ця реакція зворотна до синтезу камфену з борнеолу і називається «перегрупування Вагнера—Меєрвейна», або «камфенове перегрупування I роду». Борнеоли та їх естери використовують як пахучі речовини в парфумерній, миловарній і кондитерській промисловості. Знижують кров'яний тиск, малотоксичні. (-)-Борнеол і (-)-борнілацетат, які виділяють з ялицевої олії, є сировиною для виробництва (-)- камфори. Камфора — біциклічний кетон на основі камфану (борнану).
У структурі її молекул міститься два асиметричних атоми Карбону, проте замість чотирьох очікуваних оптичних ізомерів камфора має лише пару антиподів. Відсутність діастереомерів у камфори викликане тим, що асиметричні атоми жорстко зв'язані між собою трьома вуглецевими ланцюгами, що виключає можливість іншої конфігурації тільки в одного з цих атомів зі збереженням попередньої конфігурації в іншого. Було встановлено, що правообертаючий ізомер камфори стереохімічно відповідає конфігурації D-глюкози.
(—)-камфора Правообертаючу камфору добувають з деревини камфорного дерева (Cinnamomum Camphora), яке росте у В'єтнамі, Китаї, на Тайвані та в японії. його культивують у тропічних районах. Камфора також входить до складу ефірних олій сибірської ялиці, васильків, полину, камфорної шавлії тощо. Потреба в камфорі не задовольняється тільки природними її джерелами. Для цього розроблені різні синтетичні і напівсинтетичні методи добування, які часто відрізняються між собою лише вихідною сировиною. У нашій країні промислове значення набув метод одержання (-)-камфори з ялицевої олії, розроблений М. В. Вершиніним. До складу ялицевої олії входять а-пінен, камфен, феландрен і 30—40% борнілацетату. Останній при фракційної розгонці одержують, збираючи фракцію, що кипить вище 180°С, піддають омиленню, а (-)- борнеол, який утворився, окиснюють хромовою сумішшю в (-)-кам-фору. Промисловий синтез рацемічної камфори з пінену здійснюють за способом В. є. Тищенка. Синтез проходить в кілька стадій. На першій стадії пінен перетворюють (ізомеризують) у камфен за допомогою каталізаторів (борнофосфорної кислоти, титан(IV) оксиду, магній або нікол сульфатів): ЛІПІДи
ТіО, камфен СН3СООН; Н28О4 о—с—сн борнілацетат З Н2О (ОН )
борнеол камфора Камфора — безбарвна кристалічна речовина (т. пл. 178 °С) з різким характерним запахом, летка (сублімується), легко переганяється з водяною парою. легко розчиняється в спирті, малорозчинна у воді. Флуоресціює в УФ-світлі. За хімічними властивостями камфора — типовий кетон: вона утворює окси-ми, семікарбазони, фенілгідразони, дає інші реакції на кетонну групу (див. розд. 21.1.4). Метиленова група в а-положенні відносно карбонільної групи виявляє CH-кислотні властивості. Камфора взаємодіє з галогенами і утворює галогено-камфору:
+ Вг, ССІ4 + НВг камфора бромокамфора Окиснення камфори нітратною кислотою спочатку веде до утворення камфорної кислоти, а потім — до суміші камфанової та камфаронової кислот:
X соон ноос
соон камфаронова кислота
камфорна кислота У медицині набули широкого розповсюдження як оптично активні, так і рацемічні форми камфори. Розчини камфори використовують зовнішньо як антисептичний і місцевоподразнюючий засоб, підшкірно — стимулюють дихальний і су-динорухомий центри, обмінні процеси в серцевому м'язі, запобігають утворенню тромбів тощо. Камфора — вихідна речовина для синтезу бромокамфори. Крім медичного застосування, камфору широко використовують у промисловості як пластифікатор у виробництві целулоїду, компонента бездимних порохів, є репелентом проти молі, комарів тощо. Бромокамфора застосовується як заспокійливий засіб при захворюваннях центральної нервової системи, поліпшує серцеву діяльність. КАРОТИНОЇДИ Каротиноїдами називають групу природних пігментів, подібних за будовою до каротину (пігмент, уперше виділений з моркви). Молекули каротиноїдів містять у своєму складі значну кількість кон'югованих подвійних зв'язків, чим і пояснюється їх забарвлення. Подвійні зв'язки мають Глава 37 транс-конфігурацію. Більшість каротиноїдів належать до тетратерпенів, тобто їх молекули містять 40 атомів Карбону. Каротиноїди розчинні в оліях та тваринних жирах, багато з них легко окиснюються киснем повітря. Каротин — пігмент жовто-червоного кольору, що міститься у великій кількості в моркві, а також у молоці, вершковому маслі, листі рослин і багатьох плодах. Поява жовто-червоного забарвлення на листі дерев восени зумовлено наявністю каротину, що стає помітним унаслідок руйнування зеленого пігменту — хлорофілу. При встановленні будови каротину з'ясувалося, що він — не індивідуальна речовина, а суміш трьох ізомерів: а-каротжу, ^-каротину та у-каротину. Здебільшого в суміші переважає Р-каротин. У хімічному відношенні молекули а-, Р- та у-каротинів характеризуються наявністю одного або двох триметилцикло-гексенових кілець і полієнового вуглецевого ланцюга.
Усі ізомери каротину є попередниками вітамінів групи А, тобто провітамінами. Під впливом ферментів в організмі вони розщеплюються по зв'язку С-15—С-16 з утворенням вітаміну А1 — ретинолу. Найбільшу біологічну цінність має Р-каротин, з якого при розкладанні в організмі утворюються дві молекули вітаміну А1.
Р-каротин вітамін А1 (ретинол) Молекули а- та у-каротинів несиметричні, тому при ферментативному їхньому розщепленні утворюється лише по одній молекулі вітаміну А1.
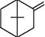
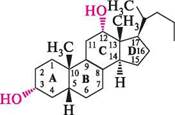
ЛІПІДи нах вітамін А1 не зустрічається, але багато з них містять його попередник (провітамін) — каротин, з якого в організмі людини і тварин утворюється вітамін А1. За фізичними властивостями — кристалічна речовина жовтого кольору (т. пл. 63—64°C), легкорозчинна в жирах. Вітамін А1 вважається фактором росту. При нестачі його в їжі спостерігається затримка росту, схуднення, висихання рогівки (ксерофтальмія), знижується опірність організму до інфекційних захворювань. Ранньою ознакою А-вітамінної недостатності є ослаблення сутінкового зору (куряча сліпота). СТЕРОЇДИ До стероїдів належать речовини тваринного та рослинного походження, в основі структури яких знаходиться система циклопентанопергідрофенантрену (сте-рану).
Наведена у формулі нумерація атомів Карбону не відповідає правилам систематичної номенклатури циклоалканів, але загальноприйнята в хімії стероїдів. циклогексанові кільця А, В і С, які входять у структуру стероїдів, перебувають в конформації «крісло». У природних стероїдах кільця А і В можуть мати цис- або транс-зчленування; кільця В і С завжди, а кільця С і D майже завжди мають транс-зчленування.
тяранс-зчленування кілець А/В, В/С та С/Т> г<ие-зчленування кілець А/В; транс-зчленування кілець В/С та С/Б циклічний скелет стероїдів — це конформаційно жорстка система, тому для нього не характерні конформаційні перетворення. При написанні формул стероїдів систему циклопентанопергідрофенантрену умовно зображують плоскою. Незаміщений циклопентанопергідрофенантрен має шість асиметричних атомів Карбону (вузлові атоми С-5, С-8, С-9, С-10, С-13, С-14) і може існувати у вигляді 64 стереоізомерів (26 = 64). При наявності замісників при невузлових атомах Карбону кількість можливих стереоізомерів значно зростає, проте у природі зустрічається лише невелика кількість з них. Для позначення конфігурації замісників і атомів Гідрогену при асиметричних центрах циклічного скелета стероїдів застосовують а, |3-систему. За цією системою конфігурацію замісників та атомів Гідрогену, розташованих під площиною циклічного скелета, прийнято позначати як и-конфігурацію, а розташованих над площиною — ^-конфігурацію. Зв'язки над площиною зображують суцільною ліні- Глава 37
єю або клином, а під площиною — переривчастою лінією або штриховим клином. У більшості природних стероїдів при атомах Карбону С-10 і С-13 знаходяться «ангулярні» метильні групи, а при С-17 — бічний вуглецевий ланцюг, який має |3-конфігурацію. Часто в положенні С-3 міститься гідроксильна або карбонільна група. У ряду стероїдів розрізняють такі групи сполук: > стерини; > жовчні кислоти; > стероїдні гормони; > аглікони серцевих глікозидів; > аглікони стероїдних сапонінів тощо. Стерини (стероли) — це стероїдні спирти, в основі структури яких знаходиться ядро вуглеводню холестану.
Каротиноїди — група полієнів, які є природними барвниками, що надають жовтих, оранжевих і червоних відтінків великій кількості рослин і деяким тваринним тканинам. Помідори забарвлені в червоний колір в основному через присутність лікопену (Чакс = 469 нм).
(З-Каротин спричиняє появу оранжевого забарвлення в моркви і манго (Хмакс = 452 нм); зеаксантин присутній також у манго і надає жовтого кольору яєчним жовткам.
ОН а-Каротин і віолаксантин присутні в апельсинах. ОН
о НО ^^ \ віолаксантин Рожеве забарвлення лосося й омарів пов'язане з присутністю астаксантину.
ЛІПІДи
У номенклатурі похідних холестану прийнята ринні стерини (зоостерини), рослинні (фітостерини) і стерини грибів (мікостерини). Зоостерини зустрічаються в організмах людини і тварин. їх вуглецевий скелет містить 27 атомів Карбону. Фітостерини містяться в рослинах, а мікостерини — у дріжджових грибках. На відміну від зоостеринів їх молекули містять 28 або 29 атомів Карбону. Важливим представником зоостеринів є холестерол. холестерол (холестерин, 5-холестен-ЗР-ол) — похідна холестану, в якому при С-3 знаходиться гідроксильна група в Р-конфігурації, а при С-5 — подвійний зв'язок. Таким чином, холестерол — ненасичений спирт. За рахунок гідроксильної групи він виявляє хімічні властивості спиртів, а за подвійним зв'язком — вступає в реакції, властиві алкенам. Холестерол уперше виділено 1775 року з жовчних каменів. Він уходить до складу клітинних мембран, у великих кількостях міститься в нервовій тканині (головному і спинному мозку), присутній у крові і жовчі. Нормальний вміст холестеролу в крові людини становить 180—260 мг%.
При порушенні холестеролового обміну він відкладається на стінках кровоносних судин і сприяє розвитку атеросклерозу. Холестерол — біогенетичний попередник стероїдних гормонів, жовчних кислот, вітаміну D3. В організмі холестерол міститься як у вільному стані, так і у вигляді естерів.
У жирі морських риб і тварин, а також у ліпідах шкіри людини міститься 7-де-гідрохолестерол, який при опромінюванні УФ-світлом перетворюється у вітамін D3 (холекальциферол). У процесі ізомеризації розривається зв'язок між С-9 і С-10.
НО1
7-дегідрохолестерол вітамін О3; холекальциферол Тому 7-дегідрохолестерол — провітамін D3. Близький за будовою до вітаміну D3 вітамін D2 (див. нижче). Вітаміни групи D регулюють обмін Кальцію і Фосфору в організмі. При нестачі вітаміну D у раціоні в дітей розвивається захворювання на рахіт. Глава 37
Під дією УФ-світла ергостерол ізомеризується у вітамін D2 (ергокальциферол). У процесі ізомеризації відбувається розрив зв'язку між С-9 і С-10. Тому ергостерин є провітаміном D2. Він міститься у великій кількості в дріжджах. Вітамін D2, як і вітамін D3, регулює обмін Кальцію та Фосфору в організмі, а отже, має антирахітичну дію.
НО1
ергостерол вітамін Т)2; ергокальциферол Жовчні кислоти.Знаходяться в жовчі людини і тварин. Вони виробляються печінкою з холестеролу. За хімічною будовою жовчні кислоти — це гідроксипохідні холанової кислоти.
холанова кислота З жовчі людини виділено чотири кислоти, з яких найбільш поширені холева і дезоксихолева кислоти.
холева кислота дезоксихолева кислота ЛІПІДи Холева кислота має три спиртових гідроксили в положеннях 3, 7 і 12, дезок-сихолева — два в положеннях 3 і 12 (відсутній у положенні 7). Усі гідроксильні групи мають а-конфігурацію, а цикли А і В — цис- зчленування. У жовчі жовчні кислоти знаходяться зазвичай не у вільному стані, а у вигляді амідів з амінокислотою гліцином H2NCH2COOH або таурином H2NCH2CH2SO3H. Так, холева кислота знаходиться у вигляді глікохолевої і таурохолевоїкислот.
глікохолева кислота таурохолева кислота Натрієві та калієві солі цих кислот, завдяки поверхнево-активним властивостям, здатні емульгувати жири і тим самим полегшують їх перетравлювання та всмоктування. Стероїдні гормони.До стероїдних гормонів належать кортикостероїди (гормони кори надниркових залоз) і статеві гормони. Кортикостероїди виробляються в корі наднирко- сн„— сн,
Найважливіші представники глюкокортикоїдів — гідрокортизон і кортизон.
гідрокортизон кортизон ці сполуки містять у положеннях С-3 кетонну, C-17 — гідроксильну і гідро-ксиацетильну групи, а в положенні С-4 — подвійний зв'язок. Гідрокортизон, крім того, має в С-11 гідроксильну групу, а кортизон, на відміну від нього, містить при С-11 карбонільну групу. Глюкокортикоїди активно впливають на вуглеводний і білковий обмін. Вони підвищують вміст глюкози в крові, сприяють нагромадженню глікогену в печінці, викликають збільшення виділення азоту із сечею. Глюкокортикоїди виявляють протизапальну та антиалергічну дії. Глава 37 Основні представники мінералокортикоїдів — альдостерон і дезоксикортико-стерон.
альдостерон дезоксикортикостерон ці сполуки містять у положеннях С-3 — кетонну, С-17 — гідроксиацетильну групи, а в положенні С-4 — подвійний зв'язок. Альдостерон, крім того, має в положенні С-11 гідроксильну групу, а в положенні С-13 — замість метильної групи альдегідну (звідси і походить його назва). Мінералокортикоїди регулюють переважно обмін Натрію, Калію, Хлору та води. Вони сприяють утриманню іонів Натрію і Хлору в організмі і виведенню із сечею іонів Калію. З природних кортикоїдів як лікарські засоби застосовують гідрокортизон, кортизон і дезоксикортикостерон. Нині у медицині широко використовуються синтетичні аналоги кортизону і гідрокортизону — преднізон, преднізолон, дексаметазон, триамцинолон тощо. ці сполуки більш активні, ніж природні кортикостероїди, діють у менших дозах, справляють менший вплив на мінеральний обмін.
сн2—он сн2—он
преднізолон дексаметазон Характерна особливість хімічної будови дексаметазону і триамцинолону — наявність у їх молекулах атома Флуору в положенні С-9. Статеві гормони. У чоловіків статеві гормони виробляються в сім'яниках (тес-тикулах), у жінок — у яєчниках. Чоловічі статеві гормони називають андрогенами (від грец. андрос — чоловік). Жіночі статеві гормони поділяють на естрогени, які утворюються у фолікулах яєчників, тому їх ще називають фолікулярними гормонами, і гестагени (гормони вагітності), що утворюються в жовтому тілі яєчників. Статеві гормони починають вироблятися з періоду статевого дозрівання. Під їх впливом відбувається формування вторинних статевих ознак. Крім того, вони беруть участь у регуляції білкового обміну, сприяють поліпшенню адаптації, підвищують стійкість організму до зміни умов зовнішнього середовища, сповільнюють процеси старіння. Андрогени. Найважливішими андрогенами є тестостерон та андростерон. ЛІПІДи
тестостерон андростерон
Обидва гормони мають дві ангулярні метильні групи. Тестостерон містить у положеннях С-3 — кетогрупу, С-17 — гідроксильну групу, а в положенні С-4 — подвійний зв'язок. Андростерон має в положенні С-3 — гідроксильну, а в положенні С-17 — карбонільну групи. Андрогени впливають на розвиток вторинних статевих ознак у чоловіків, сприяють формуванню чоловічої статури. Нині отримано синтетичні стероїди, які мають андрогенну активність (метилтестостерон). Естрогени. Найбільш важливі естрогени — естрон (фолікулін) і естрадіол.
естрон естрадіол На відміну від андрогенів, у молекулах естрону та естрадіолу кільце А ароматичне і відсутня ангулярна метильна група в С-10. Нині відкрито ряд дуже активних синтетичних естрогенів нестероїдної структури (синестрол, діетилстильбестрол, диместрол тощо).
синестрол он диетилстильбестрол Перевага естрогенів нестероїдної будови полягає в тому, що вони більш стійкі та їх можна застосовувати перорально.
Прогестерон сприяє перебігу вагітності. Під його Глава 37 тетично. Прогестерон і його аналоги застосовують при маткових кровотечах, безплідності, недоношуванні вагітності. аглікони серцевих глікозидів.Серцеві глікозиди містяться в деяких рослинах, таких як різні види наперстянки, горицвіт весняний, конвалія звичайна, строфант, олеандр тощо. У великих дозах ці сполуки — надзвичайно отруйні речовини, а в дуже малих — справляють кардіотонічну дію (стимулюють діяльність серцевого м'яза). За хімічною структурою серцеві глікозиди є О-глікозидами, у молекулах яких аглікон має стероїдну структуру, а вуглеводний фрагмент представлений залишками моно-, ди-, три- або тетрасахариду. Зв'язок між вуглеводом та агліконом Р-глікозидний і здійснюється за рахунок гідроксильної групи в С-3 циклопентанопергідрофенантренового ядра. Крім того, аглікони (геніни) містять у С-14 гідроксильну, у С-13 — метильну групи, а в С-17 — ненасичене лактонне кільце. За характером лактонного кільця серцеві глікозиди поділяють на дві групи: > карденоліди, що містять у С-17 п'ятичленне ненасичене лактонне кільце; > буфадієноліди, що мають у С-17 шестичленне ненасичене лактонне кільце.
карденолід буфадієнолід Наявність ненасичених лактонних кілець зумовлює нестійкість серцевих глікозидів у лужних розчинах, які легко гідролізують лактони. До складу вуглеводного компонента глікозидів входять широко розповсюджені в рослинному світі D-глюкоза, D-фруктоза, D-ксилоза, D-рамноза, а також зустрічаються лише в серцевих глікозидах метилпентози — D-дигітоксоза, D-дигіталоза, D-цимароза, D-фукоза тощо.
сн,
Н Н но хг х/н но 1 Іон н р-Л-дигітоксоза онно н н сн, н он р-Л-дшіталоза Н Н( н н сн, оч н н он р-7)-фукоза Сeрцеві глікозиди групи карденолідів часто містять як аглікон дигітоксигенін і строфантидин. ЛІПІДи
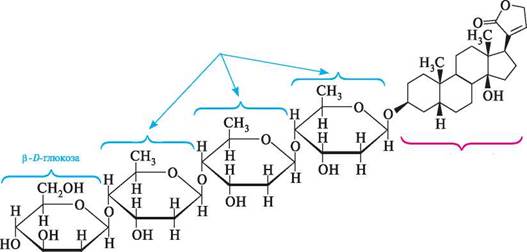
Приклад серцевого глікозиду — пурпуреаглікозид А, виділений з листя наперстянки пурпурової.
Н он У рослинах карденоліди знаходяться у вигляді так званих первинних (генуїнних) глікозидів, тобто у формі кінцевих продуктів біосинтезу. Після збору листя, і особливо в процесі їх сушіння, під дією ферментативних процесів, що перебігають, відбувається «скорочування» вуглеводного ланцюга. Унаслідок утворюються речовини, які отримали назву «вторинні глікозиди». Так, вторинним глікозидом пурпуреаглікозиду А є дигітоксин, що містить як цукровий компонент три залишки |3-Х>-дигітоксози. Дигітоксин використовують в медицині при хронічній серцево-судинній недостатності. Стероїдні аглікони сапонінів. Сапонінами (від лат. sapo — мило) називають групу рослинних глікозидів, що мають високу поверхневу активність і викликають гемоліз еритроцитів. Водні розчини сапонінів при струшуванні утворюють значну кількість піни. За хімічною природою сапоніни є О-глікозидами, в яких аглікони (сапогеніни) можуть мати стероїдну або тритерпенову структуру. Стероїдні сапоніни містяться в рослинах родини лілейних, діоскорейних, ранникових тощо. Більшість агліконів стероїдних сапонінів містить у своєму складі спірокетальне угруповання, яке утворюється внаслідок окиснення бокового ланцюга з восьми атомів Карбону, розмі- Глава 37
діосгенін щеного в положенні С-17 і гідроксильної групи — в С-16. До сапогенінів стероїдної природи належить діосгенін, що міститься в кореневищі діоскореї. Стероїдні сапогеніни використовують як вихідну сировину для виробництва синтетичних стероїдних гормонів. Так, діосгенін застосовують для синтезу гормону вагітності — прогестерону.
Поиск по сайту: |




 1 Існує і (3-пінен, який відрізняється від а-пінену положенням подвійного зв'язку.
1 Існує і (3-пінен, який відрізняється від а-пінену положенням подвійного зв'язку.

 СН
СН




 н+
н+


 СН,
СН,
 енантіомерні або рацемічні форми борнеолів містяться в багатьох ефірних оліях як у вільному стані, так і у вигляді естерів. Своєю назвою борнеол зобов'язаний борнійському лавру (Dryobalanops aromatica), у виділеннях та ефірній олії якого міститься його право-обертаючий ізомер. (-)-Борнеол добувають омиленням борнілацетату, який у кількості 30—40 % входить до складу ялицевої олії (ефірна олія ялиці сибірської (Abies sibirica)). естери борнеолу можна синтезувати, хоча і з невисокими виходами, шляхом приєднання органічних кислот до а-пінену:
енантіомерні або рацемічні форми борнеолів містяться в багатьох ефірних оліях як у вільному стані, так і у вигляді естерів. Своєю назвою борнеол зобов'язаний борнійському лавру (Dryobalanops aromatica), у виділеннях та ефірній олії якого міститься його право-обертаючий ізомер. (-)-Борнеол добувають омиленням борнілацетату, який у кількості 30—40 % входить до складу ялицевої олії (ефірна олія ялиці сибірської (Abies sibirica)). естери борнеолу можна синтезувати, хоча і з невисокими виходами, шляхом приєднання органічних кислот до а-пінену:


 -н2о
-н2о




 *он
*он
 СН
СН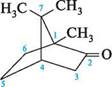
 н
н


 -сн3соон
-сн3соон



 соон
соон у-карагин
у-карагин
 Вітаміна1 (ретинол). Міститься тільки в продуктах тваринного походження. його багатими джерелами є вершкове масло, яєчний жовток, печінка тварин і морських риб, риб'ячий жир. У росли-
Вітаміна1 (ретинол). Міститься тільки в продуктах тваринного походження. його багатими джерелами є вершкове масло, яєчний жовток, печінка тварин і морських риб, риб'ячий жир. У росли-



 Полієни як природні барвники
Полієни як природні барвники
 но
но




 НО
НО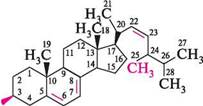 ергостерол(ергостерин, 24-метил-5,7,22-холестантриєн-ЗР-ол) належить до групи мі-костеринів. За хімічною будовою ергостерол, як і холестерол, є одноатомним ненасиченим спиртом. Але ергостерол, на відміну від хо-лестеролу, містить три подвійні зв'язки в положеннях 5, 7 і 22, а також метильну групу в положенні 24.
ергостерол(ергостерин, 24-метил-5,7,22-холестантриєн-ЗР-ол) належить до групи мі-костеринів. За хімічною будовою ергостерол, як і холестерол, є одноатомним ненасиченим спиртом. Але ергостерол, на відміну від хо-лестеролу, містить три подвійні зв'язки в положеннях 5, 7 і 22, а також метильну групу в положенні 24. НО
НО


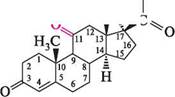
 ноос—сн2— га—с=о
ноос—сн2— га—с=о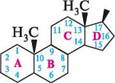 вих залоз. За хімічною природою вони є похідними вуглеводню прегнану. За характером впливу на процеси обміну кортикостероїди поділяють на дві групи: глюкокортикоїди, які регулюють вуглеводний обмін, і мінералокортикоїди, що впливають на сольовий обмін (обмін Na+, K+ і води).
вих залоз. За хімічною природою вони є похідними вуглеводню прегнану. За характером впливу на процеси обміну кортикостероїди поділяють на дві групи: глюкокортикоїди, які регулюють вуглеводний обмін, і мінералокортикоїди, що впливають на сольовий обмін (обмін Na+, K+ і води).
 сн2—он
сн2—он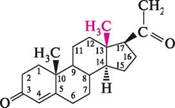 —он
—он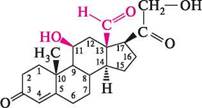


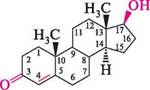
 но
но

 но
но
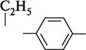
 с2н5
с2н5 О СН Гестагени. Гормоном жовтого тіла є прогестерон. За хімічною структурою прогестeрон подібний до чоловічого статевого гормону — тестостерону. Прогестерон на відміну від тестостерону в положенні С-17 містить ацетильну групу замість гідроксильної.
О СН Гестагени. Гормоном жовтого тіла є прогестерон. За хімічною структурою прогестeрон подібний до чоловічого статевого гормону — тестостерону. Прогестерон на відміну від тестостерону в положенні С-17 містить ацетильну групу замість гідроксильної.