 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Властивості вищих жирних кислот
ЛІПІДи Закінчення табл. 37.1
* Температура кипіння окремих представників ВЖК наведена при вказаному (у дужках) тиску, МПа. ** Незамінні ВЖК. Глава 37 692Г вуглецевих ланцюгів жирних кислот температури плавлення жирів підвищуються. Оскільки природні жири є сумішами триацилгліцеринів, вони не мають чітких температур плавлення. Більшість жирів плавиться при температурі 22—55 °С. Жири легкорозчинні у вуглеводнях та їх хлоропохідних, етерах, кетонах, малорозчинні в етиловому спирті (виняток становить рицинова олія, розчинна в етанолі), нерозчинні у воді, однак у присутності поверхнево-активних речовин (ПАВ), названих емульгаторами, жири утворюють високодисперсні гетерогенні системи типу емульсій. Зокрема, емульгуюча дія білків надає стабільності емульсії молочного жиру у воді — молоку. хімічні властивості жирів.як і всі естери, жири здатні піддаватися гідролізу. При наявності в молекулі тригліцериду залишків ненасичених кислот він виявляє і властивості алкенів. Гідроліз жирів. Мила. Детергенти. Унаслідок взаємодії жирів з водними розчинами гідроксидів лужних металів утворюється суміш гліцерину і натрієвих (калієвих) солей вищих жирних кислот. Солі вищих жирних кислот називають милами,а реакцію лужного гідролізу жирів, при якій утворюються мила,— омиленням1:
лужний гідроліз жирів прискорюється при заміні водного середовища на водно-спиртове. луг діє як реагент, так і емульгатор жирів, збільшуючи поверхню зіткнення жирової фази з гідролізуючим середовищем; спирт знижує в'язкість реакційного середовища. При температурі 200—225 °С і тиску 2—2,5 МПа гідроліз жирів проходить і без додавання лугу. У промисловості гідроліз жирів проводять шляхом їх нагрівання при звичайному тиску з водою в присутності сульфокислот як емульгаторів і каталізаторів (каталізатор Твітчела та контакт Петрова). Реакцію гідролізу жирів використовують в аналітичній практиці при встановленні якості жиру. З цією метою визначають так зване число омилення, яке характеризує загальний вміст вільних і зв 'язаних у тригліцериди жирних кислот. Число омилення — кількість міліграмів КОН, яка витрачається при гідролізі 1 г жиру. Величина числа омилення залежить від відносної молекулярної маси жирних кислот, залишки яких входять до складу жиру. Слід зазначити, що жири містять як домішку деяку кількість вільних карбонових кислот. Про кількісний вміст цих кислот дозволяє судити кислотне число (число нейтралізації), що визначається як кількість міліграмів КОН, необхідна для нейтралізації 1 г жиру. Різниця між числом омилення і кислотним числом складає естерове число,що характеризує вміст залишків жирних кислот, естернозв 'язаних із залишками гліцерину.
ЛІПІДи
Суміш твердих високомолекулярних жирних кислот, здебільшого стеаринової і пальмітинової, здобуту при гідролізі жирів у кислому та нейтральному середовищах, називають стеарином. Стеарин використовують разом з парафіном для виготовлення свічок. Для одержання твердого мила виділену суміш вищих жирних кислот нейтралізують содою. якщо нейтралізацію суміші вищих жирних кислот проводять за допомогою поташу (калій карбонату), то утворюється калієве («зелене») мило, що відрізняється від натрієвого рідкою консистенцією. При нейтралізації жирнокислотної суміші оксидами лужноземельних і перехідних металів (CaО, MgО, ZnО, PbО тощо) утворюються нерозчинні у воді так звані «металічні» мила, які використовуються як медичні пластирі (наприклад, простий свинцевий). Молекули мила містять у своїй структурі гідрофільний (той, що «тягнеться» до молекул води) карбоксилат-аніонний фрагмент і гідрофобний («уникаючий» контакту з водою) протяжний вуглецевий ланцюг. У результаті такої будови мила мають практично однакову здатність розчиняти як гідрофільні (вода, спирти і под.), так і ліпофільні (вуглеводні, естери тощо) речовини. Крім того, на відміну від молекул натрієвих і калієвих солей нижчих жирних кислот, молекули мила здатні до агрегації («злипання» одна з одною) з утворенням сферичних структур — міцел. У водному середовищі міцели мила мають будову, схематично зображену на рис. 37.1. У міцелі молекули мила зчеплені між собою
Поиск по сайту: |
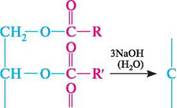 сн2—о—с—к" сн2—он
сн2—о—с—к" сн2—он 1 Термін «омилення» часто застосовують і до реакції гідролізу інших функціональних похідних кислот: естерів, амідів, нітрилів тощо і навіть до реакції гідролізу галогенопохідних вуглеводнів.
1 Термін «омилення» часто застосовують і до реакції гідролізу інших функціональних похідних кислот: естерів, амідів, нітрилів тощо і навіть до реакції гідролізу галогенопохідних вуглеводнів.