 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
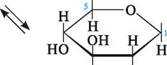
Глікозидний гідроксил аномерний центр
Н-Н- СН2ОН Д-глюкоза СН2ОН а -Л-глюкопіраноза Глава 34
но-':- сн2он НО- н- Н- сн2- р -.О-фруктопіраноза
аномерний центр
Н0- н- Н- сн2—о—н і)-фруктоза сн2— а-О-фрухгоігіраноза
но-
н- н-
СН2ОН В-глюкоза
но-2с-сн2он но-н-н- СН2ОН р -О-фруктофураноза о глікозидний гідроксил аномерний центр
0№ ] о—н сн2он ґ>- фруктоза
нон2с-с-он но-н-н- СН2ОН а-І>-фруктофураноза Внутрішньомолекулярне утворення напівацеталю приводить до того, що атом Карбону карбонільної групи перетворюється на асиметричний. цей новий хіраль-ний центр називають аномерним, а відповідні йому два нові стереоізомери — а-і §-аномерами. Гідроксильну групу, утворену в процесі циклізації моносахариду при аномерному центрі, називають напівацетальною, або глікозидною. ВУГЛеВОДи
Аномери — діастереомери, які відрізняються конфігурацією аномерного атома Карбону. В а-аномері розташування напівацеталь-ного гідроксилу таке ж саме, як і гідроксилу «кінцевого» хірального центру (асиметричного атома Карбону, що визначає належність до D- або L-ряду). Тому в проекційних формулах моносахаридів D-ряду глікозидний гідроксил у а-аномеру розташований справа від вертикальної лінії вуглецевого ланцюга, а в Р-аномері — зліва. Наведені вище зображення циклічних форм моносахаридів називаються формулами Коллі— Толленса. Проте вони громіздкі і незручні. циклічну будову моносахаридів зручніше зображувати за допомогою перспективних формул Хеуорса (1929 р.). Було запропоновано зображувати циклічні форми моносахаридів у вигляді плоских багатокутників, розташованих перпендикулярно до площини рисунка. Хімічні зв'язки циклу, що знаходяться над площиною, зображують жирними лініями, а зв'язки, розташовані за площиною,— звичайними лініями. Атом Оксигену в циклі розташовується за площиною рисунка, причому в піранозному циклі — у правому верхньому куті, у фуранозному — угорі. Символи атомів Карбону в циклі зазвичай опускаються.
шранозний цикл фуранозний цикл Для переходу від проекцій Фішера, а також формул Коллі—Толленса до перспективних формул Хеуорса враховують таке: 1. Замісники, розміщені ліворуч від вуглецевого ланцюга, зображуються 2. В альдогексоз D-ряду в піранозній формі група —CH2OH, а у фуранозній —
но н он н НО сн2он н он а-В-глюкопіраноза СН2ОН н он або ,8- СН2ОН н он Р -В-глюкопіраноза Глава 34 Слід звернути увагу на той факт, що в наведених перспективних формулах атом Гідрогену при п'ятому атомі Карбону піранозного циклу розташований під площиною, хоча в проекційній формулі Фішера знаходиться ліворуч від вуглецевого скелета. це пояснюється тим, що для утворення кисневого містка необхідний поворот фрагмента молекули навколо валентної осі зв'язку C-4— C-5. Унаслідок такого повороту гідроксильна група при C-5 наближається до групи —СНО, і відбувається замикання циклу.
СН2ОН а -/)-глюкопіраноза
СН2ОН СН2ОН СН2ОН
но-
н ,0Н Н,
н но-
н он н он а -.0-глюкофураноза Або
но- о он
,0Н Н, н он
о н- но-
н- н- СН2ОН р -О-глюкофураноза Аналогічно зображуються за допомогою формул Хеуорса піранозні і фуранозні форми кетогексоз.
ВУГЛеВОДи
При зображенні рацемічної форми а-і |3-аномерів у формулі Хеуорса символ атома Гідрогену при аномерному атомі Карбону опускають, а розташування гідроксильної групи позначають хвилястою лінією.
н он .0-глюкопіраноза таутомерія. Моносахариди — таутомерні речовини. У кристалічному стані вони мають циклічну будову. Так, D-глюкоза, здобутадроб-ною кристалізацією з етилового спирту або води, перебуває у формі а-Х>-глюкопіранози. У водному розчині циклічна форма під дією розчинника перетворюється через відкриту оксоформу на інші циклічні форми — пі-ранозні та фуранозні з а- і Р-конфігурацією аномерного центру. Таким чином, у водному розчині моносахариди існують у вигляді п'яти таутомерних форм — відкритої, а-та Р-піранозних і а- та Р-фуранозних. СН2ОН НО-
он н он он "сн2он Д-глюкоза
Уолтер Норман ХЕУОРС (ГЕВОРТ, ХЕВОРТ) (1883-1950) Англійський хімік-органік. Основні дослідження присвячені хімії вуглеводів. Запропонував (1915) новий спосіб одержання метилових етерів цукрів. Довів переважне існування піранозних форм моносахаридів. Удосконалював номенклатуру цукрів. Запропонував перспективні формули вуглеводів (формули Хеуорса). Вивчав будову вітаміну С і здійснив його перший хімічний синтез (1933). Лауреат Нобелівської премії (1937). сн2он
н он а -Д-глюкопіраноза
Глава 34 піранозні форми. Рівноважна система D-глюкози складається з |3-£>-глюкопіранози (~ 64%) і а-£>-глюкопіранози (~ 36%). Відкрита форма присутня в малих кількостях (~ 0,024%), однак цього достатньо для перебігу хімічних реакцій за участі карбонільної групи. Аналогічні таутомерні перетворення відбуваються у водних розчинах кетоз. Cхема цикло-оксо-таутомерії D-фруктози:
СН2ОН
В- фруктоза он н Р -2)-фрукгофураноза У рівноважній системі таутомерів D-фруктози переважають фуранозні форми. Здатність моносахаридів до цикло-оксо -таутомерії пояснює виявлене задовго до встановлення їх будови явище мутаротації. Мутаротація — спонтанна зміна величини оптичного обертання свіжопригото-ваних розчинів оптично активних сполук. У свіжоприготованому водному розчині глюкози спостерігається зменшення кута оптичного обертання з +112,2° до встановлення сталого значення +52,5°. Хімічною основою цього процесу є цикло-оксо-таутомерія. як відомо, кристалічна глюкоза — це а-Х>-глюкопіраноза, що має питоме обертання [а]д° = +112,2°. При розчиненні у воді ця форма через альдегідну перетворюється в інші таутомерні форми, між якими досягається стан рівноваги. У рівноважній системі перебувають усі п'ять таутомерних форм, але переважає |3-Х>-глюкопіраноза, що має [а]д = +18,7°. Зовнішнім виявленням цього процесу є поступове зменшення кута обертання до встановлення сталої величини +52,5°, характерної для рівноважної суміші таутомерів. Конформації моносахаридів.Фуранозні форми моносахаридів мають практично плоску просторову будову, а отже, замісники в п'ятичленному циклі змушені знаходитися в нестабільній заслоненій конформації. Для піранозних циклів найвигіднішою формою, що відповідає мінімуму енергії, є форма «крісло», в якій замісники знаходяться в конформації, близькій до загальмованої. Тому фуранозні форми моносахаридів термодинамічно менш вигідні, ніж піранозні. Слід зазначити, що з двох можливих типів конформації «крісло» піранозних форм 1С4 і 4С11 більш стійкою є та, в якої максимальна кількість об'ємних за-
ВУГЛеВОДи місників (група —OH і особливо —СН2OH) перебуває в екваторіальних положеннях. а- D-глюкопіраноза
н-
он н он форма «крісло» 'с4
Для більшості альдогексоз D-ряду більш вигідне «крісло» 4C1.
а -В-галактопіраноза
н
а -В-манопіраноза Для переходу від формули Хеуорса піранозного циклу до конформації «крісло» 4C1 зображують фігуру крісла з атомом Оксигену, в якій атом С-4 перебуває у верхньому, а атом С-1 — у нижньому положеннях. Глікозидний гідроксил в а-аномері розташовують аксіально і в Р-аномері — екваторіально. Решту замісників переносять з урахуванням їх цис- або транс-положення у формулі Хеуорса відносно глікозидного гідроксилу:
р -В-манопіраноза (формула Хеуорса) р -В-манопіраноза (конформація «крісло» 4С1) Глава 34 СПОСОБИ ДОБУВАННЯ Вуглеводи дуже поширені в природі. Вони утворюються в зелених частинах рослин з карбон(IV) оксиду і води в процесі фотосинтезу.
СИН,О+ иО, п Іп п І хлорофіл Найважливішим способом добування моносахаридів є кислотний гідроліз природних ди- і полісахаридів.D-Глюкозу добувають гідролізом крохмалю, суміш D-глюкози з D-фруктозою — гідролізом сахарози і т. д. Синтетичні методи застосовують переважно для добування малодоступних моносахаридів. У більшості випадків ці методи ґрунтуються на перетворенні моносахаридів, які легко виділяються з природних джерел (D-глюкоза, D-галактоза, D-маноза тощо) в інші моносахариди шляхом скорочення або подовження вуглецевого ланцюга. Деградація (розщеплення) за руффом.це oдин із класичних методів скорочення вуглецевого ланцюга, побудований на окисненні моносахаридів:
V0 он -Н Вг2(Н2О)) ОН он СН2ОН і)-глюкоза СН2ОН .О-глюконова кислота СН2ОН 2-кето-/)-глюконова кислота СН2ОН .О-арабіноза Спочатку моносахарид окиснюють у м'яких умовах до альдонової кислоти. Далі продукт окиснюють гідроген пероксидом у присутності солей Феруму(III) до 2-кетоальдонової кислоти, яка внаслідок декарбоксилювання перетворюється на моносахарид, що містить на один атом Карбону менше, ніж вихідний. Ціангідриновий синтез.Суть методу полягає в приєднанні ціановодню по по
Поиск по сайту: |
 н-но-
н-но-

 СН2ОН
СН2ОН
 При взаємодії оксогрупи з гідроксильною групою при C-4 альдогексоз або C-5 кетогексоз утворюється фуранозний п'ятичленний цикл (від назви п'ятичленного гетероциклу фуран + суфікс -оза).
При взаємодії оксогрупи з гідроксильною групою при C-4 альдогексоз або C-5 кетогексоз утворюється фуранозний п'ятичленний цикл (від назви п'ятичленного гетероциклу фуран + суфікс -оза). глікозидний гідроксил аномерний центр
глікозидний гідроксил аномерний центр н-
н-
 н
н




 4
4
 он
он Р -.О-глюкофураноза
Р -.О-глюкофураноза



 СН2ОН
СН2ОН н\он я/І
н\он я/І

 сн2он
сн2он







 1 цифри в верхніх і нижніх індексах указують на номера атомів Карбону, які знаходяться в верхніх і нижніх положеннях конформації «крісло».
1 цифри в верхніх і нижніх індексах указують на номера атомів Карбону, які знаходяться в верхніх і нижніх положеннях конформації «крісло».


 он
он н сн,он
н сн,он


 _ Vм1 \_____ , ну
_ Vм1 \_____ , ну