 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Сн—он сн—он сн—он сн—он сн—он
альдогексоза пдроксиштрил пдроксикислота аладогептоза ВУГЛеВОДи ціангідриновий синтез дозволяє нарощувати вуглецевий ланцюг і застосовується для добування вищих альдоз із нижчих. ФІЗИЧНІ ВЛАСТИВОСТІ Моносахариди — тверді гігроскопічні речовини, легкорозчинні у воді, важкорозчинні в етанолі і практично нерозчинні в діетиловому етері, у бензені, діоксані. Значна частина моносахаридів — це кристалічні речовини. Водні розчини моносахаридів переважно солодкі на смак і мають нейтральну реакцію. У розчинах молекули моносахаридів сильно сольватовані, що приводить до утворення в'язких «сиропів», з яких процес кристалізації значною мірою уповільнюється. це пояснюється, з одного боку, повільним утворенням центрів кристалізації через утруднення орієнтації молекул моносахаридів у в'язких розчинах, а з іншого боку, установленням таутомерної рівноваги з низькою концентрацією таутомера, найбільш схильного до кристалізації. Кристали багатьох моносахаридів складаються з молекул у піранозній формі. Розчини моносахаридів оптично активні. ХІМІЧНІ ВЛАСТИВОСТІ Будучи полігідроксикарбонільними сполуками, моносахариди виявляють хімічні властивості карбонільних сполук, багатоатомних спиртів, а також циклічних напівацеталів. Хімічні перетворення в ряду моносахаридів можна умовно поділити на дві групи: реакції за участі відкритих форм моносахаридів і реакції за участі циклічних форм. РЕАКЦІЇ ЗА УЧАСТІ ВІДКРИТИХ ФОРМ Відновлення.При відновленні моносахаридів воднем у присутності каталізатора (Ni, Pd), натрій борогідридом або натрій амальгамою в розведеній сульфатній кислоті утворюються багатоатомні спирти. З D-ксилози добувають спирт D-ксиліт, з D-глюкози — D-сорбіт, з D-манози — D-маніт і т. д.
V0 сн2он
н- но- н- СН2ОН он н он сн2он І)- ксиліт
V0 н- но- н- н- СН2ОН Д-глюкоза сн2он он н он он СН2ОН Л-сорбіт D-Ксиліт і D-сорбіт — кристалічні речовини, солодкі на смак, використовуються при цукровому діабеті як замінники цукру. D-Сорбіт — проміжний продукт у промисловому синтезі аскорбінової кислоти з D-глюкози. При відновленні D-фруктози утворюється еквімолекулярна суміш D-сорбіту та D-маніту, що пов'язано з перетворенням карбонільної групи при C-2 в асиметричний центр. Глава 34
Но н н СН2ОН с=о -н -он -он -
СН2ОН -он -н -он -он Но- Но- н- н- СН2ОН -
СН2ОН В-фруктоза СН2ОН В- сорбіт СН2ОН О-маніт Окиснення. Моносахариди легко окиснюються, але залежно від природи окисника та умов окиснення утворюються різні продукти. У кислому та нейтральному середовищах окиснення проходить без руйнування вуглецевого ланцюга молекули, у лужному середовищі переважно супроводжується розщепленням вуглецевого скелета. Окиснення в кислому та нейтральному середовищах. При використанні слабких окисників (бромної води або розведеної нітратної кислоти) альдози окиснюються з утворенням одноосновних поліоксикислот, які отримали загальну назву «альдо-нові кислоти». D-Глюкоза за цих умов дає D-глюконову кислоту, D-галактоза — D-галактонову кислоту і т. д.
V0 н- Но- н- н- Вг2 (Н2О) «V0 н- Но- н- н-
СН2ОН Д-глюкоза СН2ОН /)-глюконова кислота Кальцієва сіль D-глюконової кислоти — кальцій глюконат — використовується в медицині при алергійних захворюваннях, шлункових, кишкових, легеневих, маткових і носових кровотечах, різних захворюваннях шкіри, токсичних ураженнях печінки тощо.
н-
Но- н- н- СН2ОН кальцій глюконат Кетози бромною водою не окиснюються. Сильні окисники (концентрована НNO3) окиснюють у молекулі альдоз альдегідну і первинну спиртову групи з утворенням дикарбонових оксикислот, які отримали загальну назву «альдарові», або «цукрові кислоти». Так, D-глюкоза окис- ВУГЛеВОДи
нюється до D-глюкарової кислоти, D-маноза до D-галактарової (слизової) кислоти:
V0
н- но- н-
н- — до D-манарової, D-галактоза —
соон он н он он соон В-глюкарова кислота; О-цукрова кислота При окисненні кетоз за аналогічних умов відбувається розрив вуглецевого ланцюга за місцем карбонільної групи з утворенням дикарбонової кислоти. НО н н сн2он с=о -н -он -он СН2ОН О-фруктоза (конц.)
соон -н -он -он соон В-арабінарова кислота При селективному окисненні в молекулі альдози первинної спиртової групи без участі дуже схильної до окиснення альдегідної групи утворюються уронові кислоти. Окисненню в таких випадках піддають моносахариди з захищеною альдегідною групою, наприклад глікозиди:
осн, он сн, -сн3он
соон Н- но- Н-Н- ОН Н ОН ОН В-глюкуронова кислота Глава 34 Уронові кислоти дуже поширені в природі. Вони входять до складу багатьох полісахаридів. Поряд з D-глюкуроновою кислотою широко представлені D-галактуронова, D-мануронова і L-ідуронова кислоти.
н он н н н он В-галактуронова кислота О-мануронова кислота £-ідуронова кислота D-Галактуронова кислота — компонент пектину фруктів, D-мануронова кислота міститься в різних морських водоростях, D-глюкуронова і L-ідуронова кислоти входять до складу гепарину та інших полісахаридів. Уронові кислоти беруть участь у процесі виведення з організму токсичних речовин. Окиснення в лужному середовищі. Подібно до альдегідів, моносахариди окис-нюються амоніачним розчином аргентум оксиду (реактив Толленса) і купрум(II) гідроксидом у лужному розчині або з реактивом Фелінга (див. c. 388). У реакції вступають як альдози, так і кетози, тому що в лужному середовищі кетози ізоме-руються в альдози (див. епімеризація). З реактивом Толленса здійснюється реакція «срібного дзеркала». З купрум(II) гідроксидом у лужному розчині і реактивом Фелінга утворюються осад купрум(I) оксид цегляно-червоного кольору. Моносахариди при окисненні в лужному середовищі розщеплюються до утворення суміші продуктів окиснення. Ці реакції є якісними на альдози і кетози.
[А§(КН3)2]ОН
реактив Толленса
К—С+ Си2 (комплекс) Н реактив Фелінга А§і + продукти окиснення ОКИСНЄННЯ Перетворення моносахаридів під дією лугів (епімеризація). У розведених розчинах лугів при кімнатній температурі моносахариди піддаються ізомеризації з утворенням рівноважної суміші моноз, які розрізняються конфігурацією атомів Карбону C-1 і С-2. Так, D-глюкоза, витримана в розчині натрій гідроксиду (8 • 1СГ3) при 35 °С упродовж 4 діб, перетворюється в суміш, яка складається з D-фруктози (~ 28%), D-манози (~ 3%) і D-глюкози (~ 69%). Аналогічна ізомеризація спосте-рігається в кетоз (фруктози). Ізомерні перетворення моносахаридів під дією лугів називають епімеризацією і приводять до утворення епімерів. як відзначалося раніше (див. с. 624), епімерами називають діастереоізомери, що відрізняються конфігурацією тільки одного з декількох хіральних центрів (наприклад, D-глюкоза і D-маноза, D-ксилоза і D-рибоза тощо). Взаємоперетворення в слабколужному середовищі проходить через ендіольну форму, яка утворюється в результаті міграції протона від а-атома Карбону до карбонільної групи. ВУГЛеВОДи
V он н он он СН2ОН Д-глюкоза Г8+ б, 5+ ^о—н н он он СН2ОН ендіольна форма ч
V0 но- но- н- н- СН2ОН В-маноза СН2ОН с=о -н -он -он
V0 он -н он он СН2ОН Л-глюкоза —кн—с6н5; 3; -2Н2О но-н-н- =и—і\гн—с6н5 —с6н5 н он -он СН2ОН Механізм реакції. Утворення озазонів проходить у кілька стадій. Спочатку молекула моносахариду реагує з однією молекулою фенілгідразину, утворюючи фенілгідразон, який унаслідок внутрішньомолекулярної окисно-відновної реакції піддається перегрупуванню в моноімін 1,2-дикарбонільної сполуки. Потім моноімін при взаємодії з двома молекулами фенілгідразину перетворюється в озазон.
V0 он н он он сн2он й-глюкоза -н2о нч
н- но- н- н- сн2он фенілгідразон В-глюкози -н
сн2он енгідразин нс=>ш
н\ -Н,О; -Н-^ сн2он моноімін 2-кетоальцегіду но-н-н- -н -он -он СН2ОН Глава 34
Озазони — кристалічні речовини жовтого кольору, нерозчинні у воді. D-Глюкоза, D-маноза і D-фруктоза дають один і той ж озазон. Під дією хлоридної кислоти або при нагріванні з бензальдегідом озазони легко відщеплюють дві молекули фе-нілгідразину, утворюючи відповідні озони (кетоальдегіди). При відновленні озонів натрій амальгамою в слабкокислих розчинах утворюються кетози.
О З =м—ин—с6н5 -н -он -он сн2он озазон глюкози нс=о с=о н он он сн2он СН2ОН
с=о но н-н- СН2ОН В- фруктоза Таким чином, реакція моносахаридів з фенілгідразином дозволяє здійснити перехід від альдоз через озазони та озони до кетоз. Взаємодія з гідроксил аміном. Альдози легко вступають у реакцію з гідроксил-аміном, утворюючи оксими. У присутності водовіднімаючих засобів оксими можуть бути перетворені у відповідні оксинітрили, що під дією іонів Аргентуму відщеплюють HCN і утворюють оксиальдегіди, які містять на один атом Карбону менше, ніж у вихідній альдозі. За допомогою цих реакцій можна здійснити перехід від вищих альдоз до нижчих.
V0 н- но- н- н- СН2ОН Д-глюкоза "Н2° н- но- н- н-
—он он н он он СН2ОН СН2ОН оксинітрил сн2он В-арабіноза Внутрішньомолекулярна дегідратація. Пентози при нагріванні з мінеральними кислотами (HCl, H2SO4) піддаються внутрішньомолекулярній дегідратації з утворенням фурфуролу, а гексози — 5-гідроксиметилфурфуролу: ВУГЛеВОДи
н но, н. нон2с хн—не / \ но альдопентоза сн— алвдогексоза \ ,0Н н Н НС1;
НС1; І
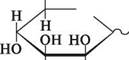
/Г\ о фурфурол НОН2С 5-гідроксиметилфурфурол Реакція дозволяє відрізнити гексози від пентоз. Фурфурол дає червоне забарвлення з аніліном у присутності хлоридної кислоти (якісна реакція на пентози). 5-Гідроксиметилфурфурол утворює червоне забарвлення з резорцином (реакція Селіванова на фруктозу). РЕАКЦІЇ ЗА УЧАСТІ ЦИКЛІЧНИХ ФОРМ Утворення глікозидів.Моносахариди, будучи циклічними напівацеталями, реагують у присутності кислотного каталізатора зі спиртами та фенолами. Реакція перебігає за участі напівацетальної гідроксильної групи і приводить до утворення циклічних ацеталів, які отримали назву «глікозиди». Незалежно від вихідної форми моносахариду в процесі реакції утворюється суміш а- і Р-глікозидів.
СН2ОН
+
но н он етил-а-/)-глюкопіранозид Назви глікозидів утворюють від назв моносахаридів, замінюючи суфікс -оза на -озид (фруктозид, галактозид, рибозид, глюкозид тощо). Залежно від розміру циклу (піранозний, фуранозний) глікозиди поділяють на піранозиди та фуранозиди. а- і Р-Аномерам моносахаридів відповідають а- та Р -глікозиди. Невуглеводну частину молекули глікозиду називають агліконом.Хімічний зв'язок між аномерним атомом Карбону моносахариду та агліконом у глікозиді називається глікозидним.
Глікозиди як ацеталі легко гідролізуються в кислому середовищі, але виявляють стійкість до гідролізу в слабколужному середовищі. У процесі гідролізу утворюється суміш а- і Р-аномерів відповідного моносахариду. Глава 34
СН2ОН
оч осн, н он метил-а -Д-глкжоїгіранозид н2о н+
оч н он і)-глюкопіраноза (суміш а- та р-аномерів) сн3он
Крім О-глікозидів відомі, N-глікозиди та S-глікозиди.
Приклад S-глікозидів — глікозид синігрин, що міститься в насінні сарептської гірчиці. У S-глікозидах аглікони — це тіоли, а зв'язок аглікону з моносахаридом здійснюється через атом Сульфуру. алкілювання.При взаємодії моносахаридів з галогеналканами або диметилсульфатом (CH3)2SO4 у реакцію вступають усі гідроксильні групи, включаючи напівацетальний гідроксил. У результаті реакції утворюються глікозиди, алкільовані по всіх гідроксильних групах. Такі сполуки в кислому середовищі гідролізуються тільки по глікозидному зв'язку. етери, що утворилися по решті гідроксильних груп, гідролізу не піддаються.
н он а -і)-глюкопіраноза СН2ОСН3 н осн3 метил-2,3,4,6-тетра-О-метил-Д-глюкопіранозид Н2О; Н+
СН2ОСН3 оч
2,3,4,6-тетра-О-метил-і)-глкжопіраноза ВУГЛеВОДи ацилювання.При взаємодії моносахаридів з ангідридами карбонових кислот легко утворюються естери за участі всіх гідроксильних груп. При дії на глюкозу оцтовим ангідридом утворюється пентаацетилглюкоза.
5(СН3СО)2О; СН3СОО№
АсОН
О
де Ас= —С—СН3 У кислому і лужному середовищах естери моносахаридів гідролізуються. Серед естерів моносахаридів важливе значення мають естери фосфатної кислоти. Вони містяться в усіх рослинних і тваринних організмах і відіграють велику роль в обміні речовин. Фосфати рибози і дезоксирибози входять до складу нуклеїнових кислот (див. гл. 36), фосфати D-глюкози і D-фруктози беруть участь в обміні вуглеводів, фосфатні естери моносахаридів — у синтезі пуринових і піримидинових нуклеотидів. Фотосинтез, бродіння та інші біологічні процеси також здійснюються за участі фосфатів моносахаридів. Нижче наведені деякі фосфати моносахаридів, які відіграють важливу роль в обміні речовин. О
о ОН О
сн,—о—р—он н он глюкозо-6-фосфат о
он н фруктозо-1,6-дифосфат
V0 сн2он
н но оч он н он а -В-ксилопіраноза; деревний цукор D-Ксилоза. є структурним фрагментом полісахариду ксилану, що міститься в деревині, соломі, соняшниковій луззі. До складу ксилану входить у вигляді а-Х>-ксилопіранози; використовується для синтезу ксиліту. Глава 34
с
н\н Он он
СН2ОН
L-арабіноза.Міститься у вільному стані в деревині хвойних порід дерев. Входить до складу рослинних глікозидів, полісахаридів рослин — арабінанів. СН2ОН і-арабіноза
-арабінопіраноза
D-Глюкоза(виноградний цукор, декстроза). широко розповсюджена в природі: у вільному стані міститься в рослинах, меді, крові; входить до складу багатьох дисахаридів (лактоза, сахароза тощо); полісахаридів (крохмаль, клітковина, глікоген і т. ін.). а-Аномер кристалізується з води (т. пл. 146°С); Р-аномер — з піридину (т. пл. 148— 150°С). р -В-глюкошраноза Глюкоза — головне джерело енергії для більшості організмів. Добувають гідролізом крохмалю або целюлози в присутності мінеральних кислот. Глюкозу використовують як сировину для виробництва вітаміну С і лікарського препарату «Кальцій глюконат»; у медицині застосовують у вигляді розчинів для внутрішньовенного введення при гіпоглікемії, інфекційних захворюваннях, захворюваннях печінки і так далі; компонент різних кровозамінників і протишокових рідин. Під дією ферментів глюкоза піддається бродінню. Відомо багато видів бродіння — спиртове, молочнокисле, маслянокисле, лимоннокисле тощо. Найважливіше з них спиртове бродіння, яке відбувається під дією ферменту дріжджів — зимази. с6н12о6 дріжджі (зимаза) 2С2Н5ОН 2СО2 цей вид бродіння використовують у промисловості для добування етанолу, а також у виноробстві та пивоварінні.
Н-но-но- н- Он н н он но
н СН2ОН н г он он D-Галактоза.Уходить до складу дисахариду лактози, що міститься в молоці, а також деяких глікозидів і полісаха-ридів. Добувають гідролізом лактози.
СН2ОН Л-галакгоза р -В-галактопіраноза ВУГЛеВОДи
V0 -н -н -он -он н но сн2он -а н он но н н он н D-маноза. це структурний фрагмент полісахариду манану, який міститься в оболонці насіння кам'яного горіха; у вільному стані знаходиться в шкірці апельсинів. Добувають гідролізом манану.
СН2ОН
с=о L-С ор н СН2ОН
і-сорбоза D-Фруктоза (плодовий або фруктовий цукор, левулоза). У вільному стані міститься у фруктах, меду; входить до складу ряду олігосахаридів (сахароза, рафіноза) і полісахаридів (інулін). Фосфати D-фруктози — проміжні продукти енергетичного обміну вуглеводів у живих організмах. Фруктоза солодша від глюкози і сахарози. Кристалічна фруктоза — це фруктопіраноза (т. пл. Р-аномеру 104°С). До складу оліго- та полісахаридів зазвичай входить у фуранозній формі. Добувають фруктозу гідролізом інуліну, що міститься в бульбах жоржини, коренях цикорію.
Поиск по сайту: |


 В-ксилоза
В-ксилоза но-н-н-
но-н-н- -н -он -он
-н -он -он -СО2; -Н2О
-СО2; -Н2О



 соон соон н
соон соон н -ОН н/ 6 5
-ОН н/ 6 5 -с6н5 -с6н5
-с6н5 -с6н5
 -ЗН2О
-ЗН2О -зн2о
-зн2о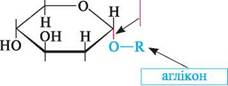 У зв'язку з тим що в молекулах глікозидів відсутній вільний напівацетальний гідроксил, вони, на відміну від моносахаридів, не здатні до таутомерії у водних розчинах, не мутаротують і не виявляють відновних властивостей.
У зв'язку з тим що в молекулах глікозидів відсутній вільний напівацетальний гідроксил, вони, на відміну від моносахаридів, не здатні до таутомерії у водних розчинах, не мутаротують і не виявляють відновних властивостей. СН2ОН
СН2ОН Глікозиди дуже поширені в природі. У переважній більшості вони є |3-глікозидами. як аглікони у природних глікозидах часто виступають гідроксиловмісні сполуки — феноли, стероїди (див. гл. 22, 37) і самі моносахариди. Зв'язок аглікону з аномерним атомом Карбону в цих сполуках здійснюється через атом Оксигену, тому такі глікозиди називають О-глікозидами. Приклад О-глікозидів — глікозид арбутин, який міститься в листках мучниці.
Глікозиди дуже поширені в природі. У переважній більшості вони є |3-глікозидами. як аглікони у природних глікозидах часто виступають гідроксиловмісні сполуки — феноли, стероїди (див. гл. 22, 37) і самі моносахариди. Зв'язок аглікону з аномерним атомом Карбону в цих сполуках здійснюється через атом Оксигену, тому такі глікозиди називають О-глікозидами. Приклад О-глікозидів — глікозид арбутин, який міститься в листках мучниці. У N-глікозидах аглікони — це залишки аліфатичних, ароматичних, гетероциклічних амінів та інші NH-вмісні органічні сполуки. Зв'язок аглікону з моносахаридом у N-глікозидах здійснюється через атом Нітрогену. До N-глікозидів належать продукти розщеплення нуклеїнових кислот і нуклеопротеїдів (нуклеотиди, нуклео-зиди), які відіграють важливу роль в обміні речовин, АТФ (див. гл. 36), а також деякі антибіотики тощо.
У N-глікозидах аглікони — це залишки аліфатичних, ароматичних, гетероциклічних амінів та інші NH-вмісні органічні сполуки. Зв'язок аглікону з моносахаридом у N-глікозидах здійснюється через атом Нітрогену. До N-глікозидів належать продукти розщеплення нуклеїнових кислот і нуклеопротеїдів (нуклеотиди, нуклео-зиди), які відіграють важливу роль в обміні речовин, АТФ (див. гл. 36), а також деякі антибіотики тощо.
 СН2ОН
СН2ОН -сн3он
-сн3он


 СН2ОН
СН2ОН
 сн2—о—р—он он
сн2—о—р—он он
 В-рибоза р-Х)-рибофураноза
В-рибоза р-Х)-рибофураноза