|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ОКРЕМІ ПРЕДСТАВНИКИ ПОХІДНИХ МОНОСАХАРИДІВ. ВИКОРИСТАННЯ
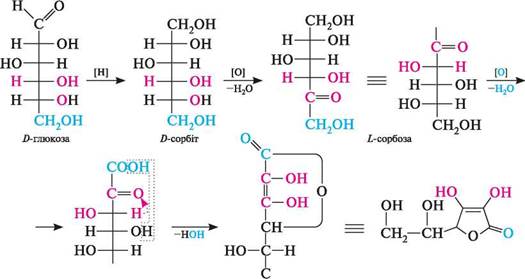
аскорбінова кислота(вітамін С, у-лактон 2,3-дегідро-L-гулонової кислоти). Водорозчинний вітамін, який міститься в багатьох овочах і фруктах. Нестача вітаміну С в їжі викликає захворювання на цингу, а також знижує опірність організму до інфекційних захворювань. Аскорбінова кислота — сильний відновлюючий агент; при окисненні перетворюється в дегідроаскорбінову кислоту, яка, у свою чергу, здатна досить легко відновлюватися до аскорбінової кислоти. ВУГЛеВОДи
аскорбінова кислота
он сн2—( дегідроаскорбінова кислота Роль вітаміну С в організмі пов'язана з його участю в окисно-відновних процесах, вуглеводному обміні, у регенерації тканин, синтезі стероїдів тощо. Аскорбінова кислота має сильні кислотні властивості (рКа = 4,2), що пов'язано з дисоціацією однієї з гідроксильних груп ендіольного фрагмента:
оч рн он 4=/ ОН сн2- аскорбат-іон У промисловості аскорбінову кислоту добувають з D-глюкози:
2-кето-£-гулонова н2он аскорбінова кислота
с=о СН2ОН Потреба у вітаміні С для людини 50—70 мг на добу. нейрамінова кислота (3,5-дідезокси-5-амінононулонова кислота). Похідна моносахариду кетононози — нону-лози. У природі нейрамінова кислота найчастіше зустрічається у вигляді N- і О-ацильованих похідних, об'єднаних загальною назвою «сіалові кислоти» (ацильним фрагментом зазвичай є залишки оцтової або гліколевої кислот). Глава 34 Сіалові кислоти — структурні компоненти глікопротеїдів (див. с. 704), специфічних речовин крові і тканин, гангліозидів мозку. ДИСАХАРИДИ Дисахаридами називають вуглеводи, молекули яких складаються з двох залишків моносахаридів однакової або різної природи, сполучених між собою глікозидним зв 'язком. Будучи O-глікозидами, дисахариди легко гідролізуються в кислому середовищі з утворенням двох молекул моносахаридів. Залежно від способу утворення глікозидного зв'язку, дисахариди розділяють на дві групи — відновні і невідновні. 34.2.1. ВІДНОВНІДИСАХАРИДИ У відновних дисахаридах глікозидний зв 'язок утворюється за рахунок напіваце-тальної (глікозидної) гідроксильної групи одного і будь-якої спиртової гідроксильної групи (частіше в С-4) іншого моносахариду. При цьому в молекулі залишається одна вільна напівацетальна гідроксильна група, унаслідок чого дисахарид зберігає здатність до цикло-оксо-таутомерії і, отже, має відновні властивості. У свіжоприго-тованих розчинах таких дисахаридів спостерігається явище мутаротації. До представників відновних дисахаридів належать: мальтоза, целобіоза, лактоза.
мальтоза (солодовий цукор). Молекула мальтози складається з двох залишків D-глюкопіранози, сполучених 1,4-глікозидним зв'язком. При цьому залишок глюкози, аномерний атом Карбону якого бере участь в утворенні глікозидного зв'язку, знаходиться в а-формі, а залишок глюкози з вільною напівацетальною гідроксильною групою може мати а-конфіїурацію (а-мальтоза) або В-конфіїурацію (В-мальтоза). Таким чином, а-мальтозу можна назвати як 4-О-(а-Х>-глюкопіранозил)-а-Х>- глюкопіраноза, а В-мальтозу — 4-О-(а-£>-глюкопіранозил)-В-£>-глюкопіраноза. У розчині мальтоза існує в альдегідній, а- та В-циклічних таутомерних формах.
СН2ОН СН2ОН СН2ОН Н он
а-форма альдегідна форма ВУГЛеВОДи
р-форма Розчини мальтози здатні до мутаротації. Мальтоза є відновним дисахаридом і дає позитивні реакції з реактивами Тол-ленса і Фелінга. За участі альдегідної форми мальтоза вступає в характерні для моносахаридів реакції.
но сн2он о н ?н І І н он
СН2ОН
о о н он н он оксинітрил мальтози
сн2он
X—он )ННХН -^5- н он
озазон мальтози При окисненні в м'яких умовах (під дією бромної води) мальтоза перетворюється в мальтобіонову кислоту:
он н он н он мальтобіонова кислота За участі циклічних форм мальтоза, подібно до моносахаридів, піддається ал-кілюванню та ацилюванню. При взаємодії мальтози з такими слабкими алкілюючими реагентами, як спирти (у присутності HCl), утворюються глікозиди. Реакція проходить за рахунок напівацетального гідроксилу. Глава 34
сн2он
он н он н мальтоза О-метилмальтозид При взаємодії мальтози з надлишком сильних алкілюючих реагентів (алкіл-галогенідів, діалкілсульфатш (КО)28О2 тощо) здійснюється алкілювання по всіх гідроксильних групах.
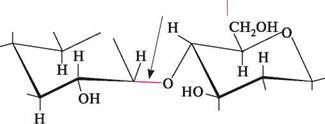
Мальтоза міститься в невеликих кількостях у деяких рослинах, утворюється при ферментативному гідролізі крохмалю. Вона легко розчиняється у воді, водні розчини мають солодкий смак. В організмі людини мальтоза розщеплюється ферментом мальтазою до D-глюкози. Целобіоза.Молекула целобіози, як і мальтози, складається з двох залишків D-глюкопіранози, зв'язаних 1,4-глікозидним зв'язком. Але, на відміну від мальтози, у молекулі целобіози залишок глюкози, напівацетальний гідроксил якого бере участь в утворенні глікозидного зв'язку, має В-конфіїурацію. Залишок же глюкози з вільною напівацетальною групою, аналогічно мальтозі, може мати а-конфігурацію (а-целобіоза) або В-конфіїурацію (В-целобіоза).
ВУГЛеВОДи Виходячи з хімічної структури, а-целобіозу можна назвати як 4-О-(|3-Х>-глюкопіранозил)-а-£>-глюкопіраноза, а Р-целобіозу — 4-О-(|3-Х>-глюкопіранозил)-Р -D-глюкопіраноза. У розчині целобіоза існує в альдегідній, а- і Р -циклічних таутомерних формах.
н он н он а-форма сн2он
СН2ОН н он н он алвдегідна форма сн2он
алвдегідна форма ЗН2Ї>(-Ш-С6Н5;
н он н он оксинітрил целобіози
СН2ОН н он н он оксим целобіози
сн,он 2-он н он озазон целобіози При окисненні целобіози в м'яких умовах утворюється целобіонова кислота. За участі циклічних форм целобіоза піддається алкілюванню та ацилюванню (див. мальтоза, с. 648). Глава 34 целобіоза і мальтоза мають різну просторову будову. У молекулі мальтози а-глікозидний зв'язок розташований аксіально, а в молекулі целобіози В-глікозидний зв'язок — екваторіально. Така просторова структура мальтози є причиною клубкоподібної будови амілози (складова частина крохмалю), а просторова структура целобіози — причиною лінійної будови целюлози.
р-мальтоза
целобіоза — безбарвна кристалічна речовина, легко розчиняється у воді. Вона не розщеплюється в організмі людини і тому не може бути використана як продукт харчування. Лактоза (молочний цукор). Молекула лактози складається з залишків D-галактопіранози і D-глюкопіранози, сполучених 1,4-глікозидним зв'язком. В утворенні глікозидного зв'язку бере участь напівацетальний гідроксил D-галактопіранози, що має В-конфігурацію. Залишок D-глюкопіранози може мати а- і В-конфігурацію, у зв'язку з чим розрізняють а- та В-лактозу.
н н он р -Д-галактопіраноза СН2ОН О. н он Д-глюкоігіраноза
| р-Г,4-глікозидний зв'язок | н І)-лактоза; 4-0- (р -В-галактоігіранозил) -О-глюкопіраноза а-Лактоза може бути названа як 4- О -(В -D-галактопіранозил) -а-Х>-глюкопіраноза, а В-лактоза — як 4-О-(В-Х)-галактопіранозил)-В-Х)-глюкопіраноза. Просторова будова лактози подібна до будови целобіози, тобто В-глікозидний зв'язок розташований екваторіально. ВУГЛеВОДи
лактоза міститься в молоці. Вона не піддається спиртовому бродінню, порівняно із сахарозою має меншу солодкість (у 4—5 разів). При кислотному або ферментативному гідролізі лактози утворюються D-глюкоза і D-галактоза. лактоза має низьку гігроскопічність, використовується у фармації при виготовленні порошків і таблеток. НЕВІДНОВНІ ДИСАХАРИДИ У молекулах невідновних дисахаридів глікозидний зв'язок утворюється за рахунок напівацетальних гідроксильних груп обох моносахаридів. Такі дисахариди не мають у своєму складі вільного напівацетального гідроксилу, тому в розчинах вони існують тільки в циклічній формі, їх розчини не мутаротують і не мають відновних властивостей. Невідновні дисахариди не дають реакцій по альдегідній групі і глікозидному гідроксилу. Вони здатні лише до утворення етерів і естерів. Представником невідновних дисахаридів є сахароза.
Науково доведено, що однією з причин руйнування зубів є зубний наліт і молочна кислота. У 1 мл слини містяться більше 100 млн різних бактерій! Відомо, що тільки бактерії штаму Зігеріососсш пшіат здатні викликати карієс зубів. як виявилося, причиною цього є фермент глюкозилтрансфераза, який утворюються на поверхні цих бактеріальних клітин. Фермент розщеплює сахарозу до глюкози і фруктози. Потім відбувається синтез полісахариду декстрану, мономерною ланкою якого є (3-_0-глюкопіраноза. Зубний наліт, що утворюється, на 10% складається з декстрану. Полісахарид міцно зв'язує емаль зуба і бактерії. Інший продукт розщеплення сахарози — фруктоза, утилізується бактеріями в результаті гліколізу і молочнокислого бродіння. Молочна кислота, що утворилася, підвищує рН середовища в порожнині рота і починає розчиняти кальцій, що входить до складу зубної емалі. Чому кислота не видаляється з поверхні зуба, хоча ми щодня виробляємо близько 1 л слини? Проблема — у зубному нальоті, що непроникний для слини й утримує бактерії та молочну кислоту на поверхні емалі. Таким чином, уживання навіть малих кількостей солодощів між основними прийманнями їжі призводить до карієсу зубів. Глава 34
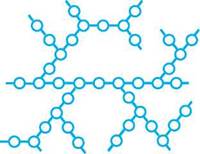
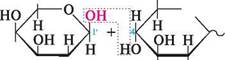
ковий цукор). Молекула сахарози складається з залишків D-глюкози і D-фруктози. При цьому D-глюкоза входить до складу сахарози у формі а-£>-глюкопіранози, а D-фруктоза у формі |3-Х>-фруктофуранози. Глікозидний зв'язок між а-£>-глюкопіранозою і |3-Х>-фруктофуранозою утворюється за рахунок напівацетальних гідроксилів обох молекул. Виходячи з хімічної структури, сахарозу можна назвати як 2-О-(а-£>-глюкопіранозил)-|3-£>-фрук-тофуранозид. Сахароза — безбарвна кристалічна речовина, добре розчиняється у воді, має солодкий смак. Розчини сахарози оптично активні [а^0 = +66,5°], не мутаротують і не виявляють відновних властивостей. Під дією мінеральних кислот або при нагріванні ферментів сахароза гідролізується з утворенням суміші D-глюкози і D-фруктози. При цьому відбувається зміна знака питомого обертання, тобто характерне для сахарози обертання площини поляризації вправо [ад° = +66,5°] змінюється на ліве обертання [а^0 = -39,5°]. У зв 'язку зі зміною в процесі гідролізу сахарози знака питомого обертання гідроліз сахарози отримав назву «інверсії». Звідси, утворювана в процесі гідролізу суміш рівних кількостей D-глюкози і D-фруктози називається інвертним цукром. Інвертний цукор — основна складова частина бджолиного меду. Причиною інверсії сахарози є відносно велике питоме обертання D-фруктози вліво Гаї;0 = -92°], ніж D-глюкози вправо [ао = 52,5°], тому суміш, що утворюється при гідролізі, виявляє ліве обертання. Сахароза міститься в цукровій тростині та цукрових буряків (17—20%), з яких неї одержують у промисловості. У фармації сахарозу використовують для приготування порошків, сиропів, мікстур тощо. ПОЛІСАХАРИДИ До полісахаридів належать сполуки, молекули яких містять більше десяти моно-сахаридних ланок, сполучених О-глікозидним зв'язком. Найчастіше полісахариди складаються з кількох сотень і навіть тисяч моно-сахаридних залишків, які утворюють лінійні (а) або розгалужені (б) полімерні ланцюги (рис. 34.1). Глікозидні зв'язки в полісахаридах, як правило, утворюються за рахунок глікозидного гідроксилу одного та спиртового гідроксилу іншого моносахаридних залишків. Здебільшого ці зв'язки виникають між C-1 і C-2, C-1 і C-3 або C-1 і C-6. На кінці полісахаридного ланцюга знаходиться відновний залишок моносаха-риду, але оскільки його частка в молекулі незначна, то полісахариди з більшою молекулярною масою практично не мають відновної здатності. ВУГЛеВОДи
Н><>(>О-О-О-О-О-О- А б Рис. 34.1. Полімерні ланцюги полісахаридів: а — лінійні; б — полімерні Якщо до складу полісахаридів входять залишки тільки одного моносахариду, то їх називають гомополісахаридами. Полісахариди, що складаються з різних моносаха-ридних одиниць, називають гетерополісахаридами. 34.3.1. ГОМОПОЛІСАХАРИДИ Гомополісахариди, побудовані з залишків пентоз, називаються пентозанами, а із залишків гексоз — гексозанами. Загальна формула пентозанів — (C5Н8O4)n, а гексозанів — (C6Н10O5)n. Переважна більшість природних полісахаридів — гексозани (крохмаль, целюлоза, глікоген, декстрани тощо). Крохмаль. Крохмаль — основне джерело резервної енергії в рослинах; міститься переважно у насінні, бульбах, коренях. Крохмаль містить приблизно 20 % розчинної у воді фракції, називаною амілозою, і близько 80% нерозчинної фракції, названої амілопектином. При поступовому кислотному і ферментативному гідролізі амілоза та амілопектин розщеплюються до декстринів (суміш полісахаридів з меншою молекулярною масою), подальший гідроліз яких приводить до утворення мальтози, а потім до D-глюкози: (С6Н10О5)„ — (С6Н10О5), —► С12Н22ОП —► С6Н12О6
Поиск по сайту: |
 он сн2—
он сн2—

 сн2он
сн2он Vої1
Vої1
 СН2ОН
СН2ОН н он н он
н он н он
 н,
н, ЗН2К-Ш-С6Н5;
ЗН2К-Ш-С6Н5; -NНз; -2Н2О
-NНз; -2Н2О

 нЛ~^н н
нЛ~^н н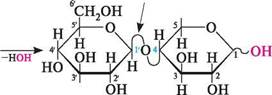 | р-Г,4-глікозидний зв'язок] СН2ОН
| р-Г,4-глікозидний зв'язок] СН2ОН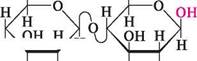
 но\[ 'н
но\[ 'н

 н он н он
н он н он -С6Н5Ш2; -КН3; -2Н2О
-С6Н5Ш2; -КН3; -2Н2О


 СН2ОН
СН2ОН

 лактоза — відновний дисахарид. У розчині вона існує в кількох таутомерних формах — альдегідній, а- та |3-циклічних. Тому розчини лактози мутаротують і дають позитивну реакцію з реактивами Толленса і Фелінга. При окисненні лактози в м'яких умовах утворюється лактобіонова кислота. Для лактози характерна низка інших реакцій, властивих відновним дисахаридам (див. мальтоза, с. 646—648).
лактоза — відновний дисахарид. У розчині вона існує в кількох таутомерних формах — альдегідній, а- та |3-циклічних. Тому розчини лактози мутаротують і дають позитивну реакцію з реактивами Толленса і Фелінга. При окисненні лактози в м'яких умовах утворюється лактобіонова кислота. Для лактози характерна низка інших реакцій, властивих відновним дисахаридам (див. мальтоза, с. 646—648).
 Сахароза і карієс зубів
Сахароза і карієс зубів СН2ОН Сахароза (тростинний або буря-
СН2ОН Сахароза (тростинний або буря-