|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
КОНДЕНСОВАНІ СИСТЕМИ ГЕТЕРОЦИКЛІВ
Важливе значення з цієї групи гетероциклів мають широко розповсюджені в природі сполуки пуринового і птеридинового рядів. П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи ПУРИН
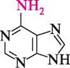
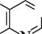
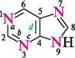
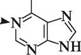
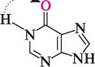
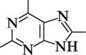
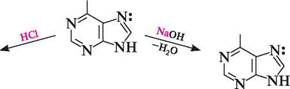
Пурин (імідазо[4,5-d]піримідин) — конденсована гетероциклічна система, яка складається з піримідинового та імідазольного кілець. Історично сформована нумерація атомів пуринового ядра не відповідає загальним правилам нумерації конденсованих систем, але є загальноприйнятою. СПОСОБИ ДОБУВАННЯ Пурин і його похідні одержують конденсацією 4,5-діамінопіримідинів з карбоновими кислотами(метод Траубе):
N11, о. С—к
Не/ ? К 2Н2О
4,5-діамінопіримідин 8-К-пурин ФІЗИЧНІ ВЛАСТИВОСТІ Пурин — безбарвна кристалічна речовина (т. пл. 217°С), добре розчиняється у воді, погано — в ацетоні, у діетиловом етері, хлороформі. БУДОВА ТА ХІМІЧНІ ВЛАСТИВОСТІ Пурин — гетероароматична сполука. його молекула має плоску будову і містить замкнену кон'юговану систему, яка складається з 10 я-електронів, включаючи неподілену пару електронів атома Нітрогену в положенні 9, що відповідає правилу Гюккеля (4n + 2, n = 2). Наявність у структурі пурину імідазольного циклу надає йому низку властивостей, характерних для імідазолу. Так, для пурину характерна азольна таутомерія:
У кристалічному стані більш імовірне перебування атома Гідрогену в положенні 7. Аналогічно імідазолу, пурин є амфотерною сполукою та утворює солі із сильними кислотами і основами:
н сг
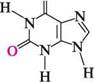
пуриній хлорид натрієва сіль пурину Глава 32 Атоми Нітрогену піримідинового циклу, унаслідок електроноакцепторного впливу один на одного та участі в делокалізації позитивного заряду пуриній-катіона, не протонуються сильними кислотами. НАЙВАЖЛИВІШІ ПОХІДНІ ПУРИНУ Найважливіші похідні пурину — оксо- та амінопурини. Оксопурини.Представниками оксопуринів є сечова кислота, ксантин і гіпоксантин.
N Н ксантин гіпоксантин ці сполуки утворюються в організмі в процесі перетворення нуклеїнових кислот. Сечова кислота, ксантин і гіпоксантин — таутомерні речовини. У результаті лактам-лактимної таутомерії вони існують у двох таутомерних формах — оксо-формі (лактамна форма) і гідроксиформі (лактимна форма). Тому в навчальній і науковій хімічній літературі оксопурини часто називають гідроксипуринами. сечова кислота
н триоксоформа
О—н
Н— о тригідроксиформа Н—о
гідроксиформа ксантин; 2,6-дигідроксшгурин
Н—о
оксоформа гіпоксантин; 6-гідроксипурин гідроксиформа П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи У кристалічному стані сечова кислота, ксантин і гіпоксантин перебувають в оксоформі. У розчинах вони існують у вигляді рівноважної суміші таутомерних оксо- та гідроксиформ, в якій переважає оксоформа. Поряд з лактам-лактимною таутомерією в оксопуринів можлива азольна таутомерія, пов'язана з міграцією протона Н+ між атомами Нітрогену в імідазольном циклі:
■ азольна таутомерія гіпоксантину Сечова кислота.Безбарвна кристалічна речовина (т. пл. 400°С), погано розчиняється у воді, в етанолі, у діетиловому етері, розчиняється в розведених розчинах лугів і гліцерині. Сечова кислота — кінцевий продукт обміну пуринових сполук в організмі, виділяється із сечею людини до 0,5—1 г на добу. Сечова кислота — двохосновна кислота (pKa1 = 5,75; pKa2 = 10,3). З водними розчинами лугів утворює кислі й середні солі.
О н
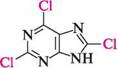
мононатрієва сіль сечової кислоти динатріева сіль сечової кислоти Солі сечової кислоти називають уратами. Кислі урати, за винятком солей літію, є малорозчинними у воді сполуками. При деяких захворюваннях, зокрема подагрі, вони відкладаються в суглобах, при нирковокам'яній хворобі — накопичуються в нирках у вигляді ниркових каменів. Основною складовою частиною ниркових каменів є мононатрієва сіль сечової кислоти. У гідроксиформі сечова кислота вступає в реакції нуклеофільного заміщення, зокрема з POCl3 утворює 2,6,8-трихлоропурин:
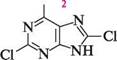
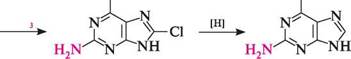
но ОН РОСІ,; І 2,6,8-трихлоропурин Унаслідок високої рухливості атомів Хлору 2,6,8-трихлоропурин широко використовується в синтезі похідних пурину — аденіну, гуаніну, гіпоксантину, ксантину тощо. Активність атомів Хлору в різних положеннях пуринового ядра в реакціях ^дг неоднакова і зменшується в ряду 6 > 2 > 8. Глава 32
гіпоксантин н ксантин При нагріванні сечової кислоти з нітратною кислотою з наступним додаванням до реакційної суміші амоніаку з'являється пурпурно-фіолетове забарвлення, пов'язане з утворенням амонійної солі пурпурної кислоти, названої мурексидом. Реакція проходить у кілька стадій. Під дією нітратної кислоти сечова кислота окис-нюється з утворенням суміші алоксану та діалурової кислоти, які, реагуючи між собою, дають алоксантин, що перетворюється в надлишку амоніаку в мурексид. ця реакція, що отримала назву «мурексидна реакція», використовується для якісного виявлення сечової кислоти та інших сполук, що містять пуринове ядро.
о нж>,
алоксан діалурова кислота 0 0 0 0
НN >^0^Г НN кн3 О
пурпурова кислота (кетоформа) 0 0 0 0 .^ X X ^г. ИН3 ^ О н пурпурова кислота (енольна форма) мурексид; амоній пурпурат П'яти- та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи Гіпоксантин (6-гідроксипурин) і ксантин (2,6-дигідроксипурин) за хімічними властивостями аналогічні сечовій кислоті. Вони існують у двох таутомерних формах — лактамній і лактимній. Подібно до сечової кислоти, ці сполуки утворюють солі з лугами. Гіпоксантин і ксантин мають також слабко виражені основні властивості та утворюють солі із сильними мінеральними кислотами, тобто вони амфотерні.
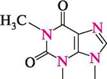
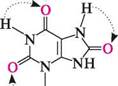
СГ хлороводнева сіль гіпоксантину натрієва сіль гіпоксантину Гіпоксантин і ксантин широко розповсюджені в рослинному та тваринному світі. Важливе значення у фармації мають N-метильні похідні ксантину — теофілін (1,3-диметилксантин), теобромін (3,7-диметилксантин) і кофеїн (1,3,7-триметил-ксантин).
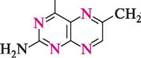
ці природні речовини є алкалоїдами. Теофілін міститься в листках чаю, теобромін — у бобах какао, кофеїн — у листках чаю та зернах кави. Теофілін, теобромін і кофеїн добувають із природної сировини або синтетично — шляхом метилювання ксантину. За фізичними властивостями вони — безбарвні кристалічні речовини, легкорозчинні в гарячій воді, погано — у холодній. Теофілін і теобромін є амфотерними сполуками. їх кислотні властивості зумовлені рухливістю атома Гідрогену в ІЧН-фрагменті молекул, основні — наявністю піридинового атома Нітрогену N-9. Кофеїн виявляє тільки слабкі основні властивості, зумовлені наявністю атома Нітрогену в положенні 9. Теофілін і теобромін мають сечогінну дію, кофеїн впливає на центральну нервову систему. амінопурини. Найважливіші амінопохідні пурину — аденін (6-амінопурин) і гуанін (2-аміно-6-гідроксипурин), що входять до складу нуклеїнових кислот як пуринові основи. Гуанін існує в двох таутомерних формах — лактамній і лактимній. Більш стійка лактамна форма, у вигляді якої гуаніновий фрагмент входить до складу нуклеїнових кислот.
аденін гуанін Глава 32 Аденін і гуанін — безбарвні кристалічні речовини, важкорозчинні у воді, добре розчиняються в лугах. Вони утворюються внаслідок гідролізу нуклеїнових кислот. В організмі аденін і гуанін піддаються дезамінуванню з утворенням гіпоксантину і ксантину, які згодом окиснюються в сечову кислоту. У медичній практиці широко використовують лікарські препарати — похідні пурину.
соон
СН3 СН2СН(ОН)СН2К(СН3)(СН2)2ОН ксантинол нікотинат; компламін (засіб, який впливає на тонус кровоносних судин) Ряд ефективних противірусних і протипухлинних препаратів утворений на основі нуклеозидів пурину (див. с. 687). ПТЕРИДИН
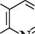
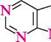
Молекула птеридину (піразино[2,3-d]піримідин) — конденсована гетероциклічна система, яка складається з піримідинового і піразинового циклів. Нумерацію атомів здійснюють, як показано на структурній формулі. СПОСОБИ ДОБУВАННЯ Похідні птеридину досить широко розповсюджені в природі. Уперше птериди-ни виділені 1895 року з пилку крил метеликів, що знайшло відображення в назві (грец. птеро — крило). Синтетично птеридини частіше добувають конденсацією 4,5-діамінопіримідинів з 1,2-дикарбонільними сполуками.
іТ™2 о^
+ 2Н2О
4,5-діамшопіримідин гліоксаль птеридин П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи ФІЗИЧНІ ВЛАСТИВОСТІ Птеридин — кристалічна речовина (т. пл. 137—138 °С) світло-жовтого кольору, добре розчиняється у воді, в етанолі, малорозчинна в діетиловому етері та бен-зені. ХІМІЧНІ ВЛАСТИВОСТІ Птеридин — гетероароматична сполука. ядро птеридину стійке до дії окис-никш, виявляє основні властивості. Унаслідок електроноакцепторного впливу чотирьох атомів Нітрогену піридинового типу електронна густина на атомах Карбону значно зменшується і знижується ароматичний характер птеридинової системи. Так, птеридин нестійкий до дії кислот і лугів, які залежно від умов викликають розкриття піримідинового або піразинового циклів, але легше розщеплюється піримідинове кільце. Він не вступає в реакції електрофільного заміщення. Уведення електронодонорних замісників (—NH2, —OH тощо) у молекулу птеридину збільшує електронну густину в ядрі і підвищує його стабільність. як слабка основа + = 4,12) птеридин протонується по атому Нітрогену в положенні 1.
с Н2° ОН"
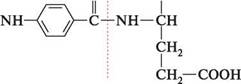
Для птеридинової системи характерні реакції алкілювання по атомах Нітрогену. НАЙВАЖЛИВІШІ ПОХІДНІ ПТЕРИДИНУ Фолієва кислота(вітамін Вс). Молекула фолієвої кислоти включає три структурні фрагменти — птеридинове ядро, залишки п-амінобензойної і L-глутамінової кислот.
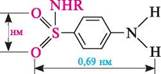
фолієва кислота Фолієва кислота вперше виділена 1938 року з екстракту печінки. У великій кількості міститься в листках шпинату, моркви та інших овочів. Назва кислоти пов'язана з виділенням її з листків шпинату (від лат.folium — лист). У людському організмі фолієва кислота не синтезується. Потреба організму в цьому вітаміні задовольняється за рахунок надходження з продуктами харчування і синтезу мікроорганізмами кишечнику. Біологічна роль фолієвої кислоти пов'язана не з вільною Глава 32 формою, а з частково відновленою птеридиновою похідною — 5,6,7,8-тетрагідро-фолієвою кислотою. Фолієва кислота стимулює кровотворення, біосинтез нуклеїнових кислот, білковий і вуглеводний обмін. Використовується в медичній практиці для лікування деяких форм анемії. Фолієва кислота — це стимулятор росту мікроорганізмів. Бактеріостатична дія сульфаніламідних препаратів ґрунтується на порушенні біосинтезу фолієвої кислоти. Маючи структурну подібність до n-амінобензойної кислоти, сульфаніламіди зв'язуються з птеридиновим фрагментом замість n-амінобензойної кислоти. У результаті блокується наступна конденсація з глутаміновою кислотою і тим самим припиняється біосинтез фолієвої кислоти, що веде до загибелі мікроорганізмів.
я-амінобензойна кислота сульфаніламід
Поиск по сайту: |

 N
N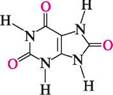
 О О
О О

 н—о
н—о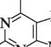

 о
о




 о" >щ і>л - ;с=о
о" >щ і>л - ;с=о 1 он 1 X ^ч.
1 он 1 X ^ч.

 ОН
ОН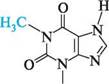

 СН,
СН,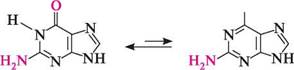 он
он