 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Артур Рудольф ГАНЧ (ХАНЧ) (1857-1935)
Німецький хімік-органік. Основні наукові праці присвячені синтезу і стереохімії органічних сполук. Відкрив (1882) реакцію одержання похідних піридину циклоконденсацією естерів (3-кетокислот з альдегідами або кетонами і амоніаком (синтез Ганча). Синтезував тіазол (1887), імідазол, оксазол, селенозол. Висунув (1890) теорію стереоізомерії молекул, які містять подвійний зв'язок N=C. Показав (1894), що діазосполуки можуть існувати у вигляді син- і анти-форм. Досліджував таутомерію нітросполук і виділив (1896) дві таутомерні форми фенілнітрометану. Вивчав взаємозв'язок кольору і структури органічних сполук. Висунув (1923) теорію псевдокислот і псевдооснов.
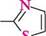
2-аміно-З-метилтіазолш йодид 2-іміно-З-метилтіазолін 2-Амінотіазол широко використовують у виробництві лікарських засобів.
СООН
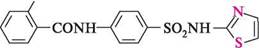
сульфатіазол; норсульфазол фталілсульфатіазол; фталазол N ШІСОСН, Ряд похідних 2-амінотіазолу — це сульфаніламідні препарати (норсульфазол, фталазол тощо), що мають антибактеріальну дію (див. с. 510). Глава 32 Пеніциліни— група антибіотиків, продукованих різними видами плісеневих грибів Penicillium, та їх аналоги напівсинтетичного виробництва. В основі структури пеніцилінів лежить конденсована гетероциклічна система, яка складається з тіазолідинового та Р-лактамного кілець. Загальна формула пеніцилінів
тіазолідинове кільце р-лактамне кільце У медичній практиці знайшли широке застосування такі природні пеніциліни, як бензилпеніцилін (R = —CH2C6H5), феноксиметилпеніцилін (R = —CH2OC6H5) тощо, а також напівсинтетичні пеніциліни — ампіцилін [R= —CH(NH2)C6H5],
Оксацилін К = ; диклоксацилін К = Тощо. Препарати групи пеніциліну — важливі антимікробні засоби. ОКСАЗОЛ ,—NОксазол (1,3-оксазол) — безбарвна рідина (т. кип. 69°C), добре змішу-Ц5і$> ється з етанолом і етером. О Оксазоли — гетероароматичні сполуки. Однак унаслідок електроно- акцепторного впливу атома Нітрогену вони важко вступають у реакції електрофільного заміщення. ці реакції можуть відбуватися в положеннях 4 і 5, якщо оксазольний цикл активований електронодонорними замісниками (аміно-або гідроксигрупа). Завдяки вільній парі електронів атома Нітрогену піридинового типу оксазоли виявляють слабкі основні властивості. Для синтезу оксазолш широко використовують метод циклодегідратації а-ациламінокетонш у присутності мінеральних кислот.
НС—N // \\
Н25О4
-н,о а-ацетиламшопропанон 2,5-диметилоксазол Серед похідних оксазолу відомі речовини, які виявляють жарознижуючу, анальгетичну, антибактеріальну та снотворну дії.
ІЗОКСАЗОЛ Ізоксазол (1,2-оксазол) — безбарвна рідина (т. кип. 95°C), обмежено розчинна у воді, добре розчиняється в органічних розчинниках. П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи Ізоксазол має ароматичні властивості. Реакції електрофільного заміщення (галогенування, нітрування, сульфування) відбуваються переважно в положенні 4, яке найменше піддається впливу гетероатомів. як і оксазол, ізоксазол — слабка основа (рKBH+ = 1,3). Загальним методом добування ізоксазолу та його похідних є реакція 1,3-дикар-бонільних сполук з гідроксилам і ном: Н3С Н2С—С 2/ \\ о \\О он
Н3СГ І Н2С—С 2/ \\
N но -н2о н3с Не—с // \\ ^С N
Ацетилацетон Ацетилацетон оксим Диметшгізсжсазал Ряд лікарських препаратів створений на основі ізоксазолів — антибіотики оксацилін та диклоксацилін (див. с. 564), протитуберкульозний засіб — циклосерин. До складу численної групи сульфаніламідних препаратів (бісептол, ко-тримоксазол, бактрим тощо) входить сульфаметоксазол (див. с. 510).
О Циклосерин
Поиск по сайту: |







 -н2о
-н2о