|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ШЕСТИЧЛЕННІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ З ОДНИМ ГЕТЕРОАТОМОМ
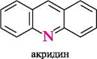
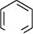
Найважливішими представниками цієї групи сполук є нітрогеновмісні гете-роцикли — піридин, хінолін, ізохінолін, акридин, а також оксигеновмісні гетеро-цикли — а-піран і у-піран:
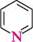
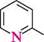
Піридин
О А-шран
О У-піран ПІРИДИН
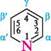
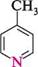
За хімічною будовою піридин (азин)1 можна розглядати як аналог бензену, у молекулі якого група —СН= заміщена атомом Нітрогену. Для назви похідних піридину здійснюють нумерацію атомів циклу або використовують позначення грецькими літерами. Положення 2,6 називають а, а'; положення 3,5 — |3,|3'; положення 4-у.
Глава 32 566 Г
2-етилпіридин; 3-етилпіридин; 4-еталпіридин; а-еталпіридин р-етилпіридин у-еталпіридин СПОСОБИ ДОБУВАННЯ Піридин та його монометильні похідні — а-, |3- і у-піколіни — містяться в невеликих кількостях у кам'яновугільній смолі (продукт сухої перегонки кам'яного вугілля), з якої їх виділяють в індивідуальному вигляді. Відомо кілька синтетичних методів одержання піридину та його гомологів, найбільш важливі з них ґрунтуються на реакції конденсації альдегідів з амоніаком. Так, з ацетальдегіду та амоніаку при 400°C у присутності каталізатора Al2O3 утворюється суміш, яка складається головним чином з 2- і 4-метилпіридинів:
ацеталвдегід а-піколін у-ігіколін При нагріванні акролеїну з амоніаком переважно утворюється Р-піколін:
+ 2Н2О акролеїн р-піколін Конденсацією ацетальдегіду і формальдегіду з амоніаком одержують незамі-щений піридин: 2СН3—С + Н—С + КН3 ----------- ► | 1 + ЗН2О+ Н2 н н и Використовуючи інші альдегіди та їх суміші, можна добувати різні алкілпіри-дини. Синтез піридину також здійснюють при взаємодії ацетилену з ціанідною кислотою:
2НС=СН + Н— С=М ФІЗИЧНІ ВЛАСТИВОСТІ Піридин — безбарвна рідина з характерним неприємним запахом (т. кип. 115 °C), що змішується з водою, етанолом і більшістю органічних розчинників. П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи БУДОВА ТА ХІМІЧНІ ВЛАСТИВОСТІ Піридин — гетероароматична сполука, яка містить циклічну шести-я-електронну кон'юговану систему (див. с. 526). Неподілена пара електронів атома Нітрогену не бере участі в утворенні ароматичного секстету та зумовлює основні властивості піридину. На відміну від бензену, у молекулі піридину електронна густина розподілена нерівномірно, що підтверджує порівняно великий дипольний момент (2,26 Db). Унаслідок електроноакцепторного впливу атома Нітрогену в піридиновому циклі на всіх атомах Карбону електронна густина знижена, причому більшою мірою — у положеннях 2, 4 і 6 (а- і у-положення), меншою — у положеннях 3 і 5 (|3-положення). Піридин — п-дефіцитна гетероароматична система. Вплив атома Нітрогену на електронну густину піридинового ядра порівняно з впливом нітрогрупи на бензенове кільце в молекулі нітробензену:
шридин
N02 нітробензен Характерні для піридину реакції можна умовно розділити на три групи: > реакції за участі гетероатома; > реакції заміщення атомів Гідрогену піридинового циклу; > реакції відновлення та окиснення. реакції, які відбуваються за участі гетероатома. Взаємодія з кислотами.Піридин є слабкою основою. Основність піридину (рKВН+ = 5,25) близька до основності аніліну (рKВН+ = 4,6). Водні розчини піридину забарвлюють червоний лакмусовий папір у синій колір. При взаємодії із сильними мінеральними та органічними кислотами (хлоридна, бромідна, сульфатна, пікринова тощо) піридин утворює піридинієві солі, які добре кристалізуються:
+ НВг Вг" піридиній бромід Утворення солі з пікриновою кислотою використовують для ідентифікації піридину. Взаємодія із сульфур(VI) оксидом. За участі неподіленої пари електронів атома Нітрогену піридин порівняно легко реагує із сульфур(VI) оксидом, утворюючи донорно-акцепторний комплекс — піридинсульфотриоксид:
+ 80,
піридинсульфотриоксид Глава 32 Піридинсульфотриоксид використовують в органічному синтезі як м'який суль-фуючий реагент при сульфуванні ацидофобних гетероциклів (див. c. 533). Взаємодія з алкіл- та ацилгалогенідами. При взаємодії з алкіл- та ацилгалоге-нідами піридин утворює четвертинні солі N-алкіл- і N-ацилпіридинію відповідно. У цих реакціях атом Нітрогену молекули піридину виявляє нуклеофільні властивості, надаючи пару електронів для утворення зв'язку з електрофільним атомом Карбону молекули галогеналкану або галогенангідриду карбонової кислоти:
^
■ІЇГ
У/ СН, сг
ТЧ-метилпіридиній йодид ЇЧ-ацетилпіридиній хлорид Солі N-ацилпіридинію характеризуються високою реакційною здатністю ацильного фрагмента відносно нуклеофілів і тому є ефективними ацилюючими реагентами. реакції заміщення атомів Гідрогену піридинового циклу. Для піридину характерні реакції електрофільного та нуклеофільного заміщення (8Е, 8^.
Реакції електрофільного заміщення в піридиновому циклі проходять лише за жорстких умов. Так, нітрування здійснюється з низьким виходом при нагріванні піридину з калій нітратом у димучій сульфатній кислоті при 300°C, сульфуванні — при нагріванні з олеумом (220—270 °С) у присутності каталізатора — меркурій(ІІ) сульфату, бромуванні — можливе при дії брому в олеумі. електрофільний реагент направляється в |3-положення циклу:
Н28О4 • 8О3; Н88О4 220 °С а Вг
З -нітропіридин N 8О3Н З-бромопіридин 3-піридинсульфокислота Реакції алкілювання та ацилювання за Фріделем—Крафтсом для піридину не характерні. Низька реакційна здатність піридинового циклу в реакціях електрофільного заміщення та орієнтація заміщення в ^-положення зумовлені електроно-акцепторними властивостями гетероатома (-I-, —M-ефекти), який, знижуючи електронну густину на всіх атомах Карбону циклу, меншою мірою впливає на |3-положення, що і визначає місце атаки електрофільним реагентом. Крім того, П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи
у реакціях із протонними реагентами (нітрування, сульфування) піридин утворює по гетероатому солі піридинію, а з галогенами — донорно-акцепторні комплекси, в яких на атомі Нітрогену з'являється позитивний заряд, а це, у свою чергу, приводить до ще більшої дезактивації піридинового циклу.
Вг" н ^ і вг піридиній гідросульфат К-бромопіридиній бромід Реакції нуклеофільного заміщення внаслідок зниження електронної густини на атомах Карбону піридинового циклу полегшуються. На відміну від бензену, піридин досить легко реагує з нуклеофільними реагентами, утворюючи продукти заміщення в положеннях 2, 4 або 6 (а- і у-положення). З реакцій нуклеофільного заміщення найбільше відомі амінування за Чичибабіним, яке ґрунтуються на взаємодії піридину з натрій амідом NaNH2 у середовищі рідкого амоніаку при нагріванні. Унаслідок реакції утворюється 2-амінопіридин.
№№І2; і
N
>гн,
ІЧІШа
Поиск по сайту: |



 1 Азинами називають шестичленні гетероароматичні нітрогеновмісні сполуки, які містять у циклі хоча б один піридиновий атом Нітрогену, а також бі- і поліцикличні системи на основі азинового циклу.
1 Азинами називають шестичленні гетероароматичні нітрогеновмісні сполуки, які містять у циклі хоча б один піридиновий атом Нітрогену, а також бі- і поліцикличні системи на основі азинового циклу.
 Р
Р










 СН
СН