|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
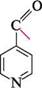
Цвітер-юн нікотинової кислоти
При нагріванні піридинкарбонові кислоти декарбоксилюються. а-Кислоти відщеплюють карбон(IV) оксид досить легко, |3- і у-кислоти декарбоксилюються при нагріванні з лугом.
соон
СО2! ізонікотинова кислота Унаслідок електроноакцепторного впливу гетероатома піридинкарбонові кислоти є сильнішими кислотами, ніж бензойна кислота:
У молекулах піколінової та ізонікотинової кислот карбоксильна група перебуває в кон'югації з гетероатомом, тому ці кислоти виявляють сильніші кислотні властивості, ніж нікотинова кислота. Піридинкарбонові кислоти широко використовуються в синтезі лікарських за-собів. Так, нікотинова кислота та її амід (нікотинамід) відомі в медичній практиці як дві форми вітаміну РР (кислота є провітаміном, а амід — вітаміном РР). При нестачі вітаміну РР в організмі розвивається захворювання шкіри — пелагра. Добова потреба людини в нікотиновій кислоті становить 20—30 мг і задовольняється в основному за рахунок харчових продуктів — молока, риби, овочів, фруктів, гречаної крупи тощо. N,N-Діетиламід нікотинової кислоти у вигляді 25 %-вого водного розчину під назвою «Кордіамін» використовують як засіб, що стимулює центральну нервову систему, збуджує дихальний і судиноруховий центри головного мозку. Амід нікотинової кислоти і N,N-діетиламід нікотинової кислоти синтезують з нікотинової кислоти:
8О
" тчн.
нікотинамід
нікотинова кислота хлорангідрид нікотинової кислоти (С2Н5)2ШІ
нікотинової кислоти Глава 32 На основі похідних ізонікотинової кислоти створені лікарські препарати (ізоніазид, фтивазид), що застосовують при лікуванні туберкульозу. Схема синтезу ізоніазиду і фтивазиду:
У/ он
-неї с2н5он, -неї
ізонікотинова кислота хлорангідрид ізонікотинової кислоти етиловий естер ізонікотинової кислоти гідразид ізонікотинової кислоти; ізоніазид
ізоніазид 4-гідрокси-З-метокси- бензиліденгідразид ізонікотинової кислоти; фтивазид + н2о
Піперидин(гексагідропіридин) — безбарвна рідина з різким амоніач-ним запахом (т. кип. 106°C), змішується з водою та більшістю органічних розчинників. Піперидин виявляє хімічні властивості вторинних амінів — утворює солі з кислотами, з нітритною кислотою — N-нітрозопохідні, вступає в реакції алкілювання та ацилювання по атому Нітрогену тощо. як вторинний амін піперидин значно сильніша основа, ніж піридин (рKВН+ піперидину у воді становить 11,22; рKВН+ піридину — 5,25). Піперидиновий цикл — структурний фрагмент алкалоїдів лобеліну, анабазину (див. с. 615), уходить до складу деяких лікарських препаратів.
о
промедол (болезаспокійливий засіб) галоперидол (нейролептичний засіб) П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи ХІНОЛІН
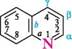
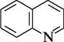
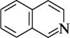
Хінолін (бензо[b]піридин) — це конденсована гетероциклічна система, яка складається з піридинового і бензенового кілець. Нумерацію атомів у молекулі хіноліну починають з гетероатома, атоми Карбону в піридиновому циклі позначають літерами а, |3 і у. СПОСОБИ ДОБУВАННЯ Хінолін уперше виділений німецьким хіміком-органіком Фрідлібом Фер-динандом Рунге 1834 року з продуктів перегонки кам'яновугільної смоли. Кам'яновугільну смолу і нині використовують для добування хіноліну та деяких його метилпохідних. Найважливіші способи синтезу хіноліну та його похідних — це синтез Скраупа і синтез Дебнера—Міллера. Синтез Скраупа.Реакція ґрунтуються на взаємодії аніліну та його заміщених у ядрі похідних, що мають вільне орто-положення, із гліцерином, концентрованою сульфатною кислотою та окисником при нагріванні. як окисник частіше використовують нітросполуку, що відповідає вихідному аміну. Для добування хіноліну за методом Скраупа нагрівають анілін з гліцерином і концентрованою сульфатною кислотою в присутності окисника — нітробензену:
сн2—он сн—он сн2— он анілін гліцерин хінолін Механізм реакції включає три послідовні стадії. На першій стадії гліцерин під дією концентрованої сульфатної кислоти піддається внутрішньомолекулярній дегідратації з утворенням акролеїну.
Н28О4; і
сн2—сн—сн2 он он он акролеїн На другій стадії акролеїн, що утворився, вступає в реакцію з аніліном:
ч гі н2с=сн—с
н З -аншінопропаналь 4-гідрокси-1,2,3>4-тетра-гідрохінолін н 1,2-дигідрохінолін Глава 32
Спочатку відбувається нуклеофільне приєднання молекули аніліну за місцем розриву активованого подвійного вуглець-вуглецевого зв'язку молекули акролеїну. Потім 3-ані-лінопропаналь, який утворюється, у кислому середовищі піддається циклізації, перетворюючись при цьому в 1,2-дигідрохінолін. Замикання циклу зумовлюється електро-фільною атакою карбонільною групою орто-положення бензенового кільця. На третій стадії реакції 1,2-дигідрохінолін окиснюється нітробензеном до хіноліну.
(1850-1910)І^А^СН;, -с6н5кн2; -2Н2О Австрійський хімік-органік. Основні наукові праці зв'язані зі з'ясуванням будови і проведенням синтезу алкало- їдів групи хініну. Відкрив (1880) син- У процесі окиснення нітробензен кіль- утворюються похідні хіноліну з замісниками в бензеновому ядрі. Реакція відкрита 1880 року австрійським хіміком-органіком Зденко Хансом Скраупом. Синтез Дебнера — міллера.цей спосіб є модифікацією синтезу Скраупа і використовується для добування похідних хіноліну з алкільними замісниками в піридиновому циклі. Синтез Дебнера—Міллера полягає в нагріванні первинного ароматичного аміну з альдегідом (здатним до кротонової конденсації) у присутності цинк хлориду, хлоридної або інших кислот. Механізм реакції подібний до механізму реакції Скраупа. На першій стадії проходить кротонова конденсація двох молекул альдегіду з утворенням а,|3-ненасиченого альдегіду, який, як і в синтезі Скраупа, взаємодіє потім з ароматичним аміном. Роль окисника виконують азометини C6H5—N=CH—R, які утворюються в процесі реакції. .О ,0
сн3—сн=сн— н кротоновий алвдегід
н н 3-анішнобутаналь П'яти- та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи
2-метил-1,2-дигідрохіналін 2-метилхінолін Реакція відкрита 1881 року О. Дебнером і В. Міллером. ФІЗИЧНІ ВЛАСТИВОСТІ Хінолін — безбарвна рідина з дуже неприємним запахом (т. кип. 237°С), добре змішується з водою, етанолом, діетиловим етером та іншими органічними розчинниками, переганяється з водяною парою. ХІМІЧНІ ВЛАСТИВОСТІ Хінолін — гетероароматична сполука. Молекула має плоску будову і містить замкнену кон'юговану я-електронну систему з 10 я-електронів, яка відповідає правилу Гюккеля. За хімічними властивостями хінолін нагадує піридин. Для нього характерні реакції за участі гетероатома, реакції електрофільного та нуклеофільного заміщення атомів Гідрогену хінолінового ядра, а також реакції окиснення та відновлення. реакціїза участі гетероатома.Наявність у молекулі хіноліну атома Нітрогену піридинового типу надає сполуці основних властивостей. як основа хінолін дещо слабший від піридину (рKВН+ хіноліну — 4,94; рKВН+ піридину в H2O — 5,25). За участі гетероатома хінолін, аналогічно піридину, утворює солі із сильними кислотами, алкіл- та ацилгалогенідами:
Сн,
>[-ацетилхшолішй хлорид сн3 К-метилхінолшій йодид реакції електрофільного та нуклеофільного заміщення ^ SN). електронна густина в молекулі хіноліну порівняно з бензоаналогом нафталеном менша і нерівномірно розподілена через електроноакцепторний вплив гетероатома: у піридиновому кільці вона нижча, ніж у бензеновому. Тому при дії електрофільними реагентами заміщення, як правило, відбувається по бензеновому кільцю, а нуклеофільними — по піридиновому. Реакції електрофільного заміщення в молекулі хіноліну проходять переважно в положеннях 5 і 8. Так, при нітруванні нітруючою сумішшю утворюється суміш 5-і 8-нітрохінолінів; сульфування концентрованою сульфатною кислотою при 220°C приводить до утворення 8-хінолінсульфокислоти, а при 300 °C — термодинамічно Глава 32 вигіднішої 6-хінолінсульфокислоти (у цих умовах 5- і 8-ізомери перегруповуються в 6-ізомер).
,; Н28О4
N0,
8-нітрохінолін (~ 48 %)
Н28О4; 220 °С
8О3Н 8 -хінолінсульфокислота 300 °С
Н28О4; 300 °С НО38 6-хінолшсульфокислота У реакції нуклеофільного заміщення хінолін вступає легше, ніж піридин. При цьому, як і в кільці піридину, нуклеофільній атаці піддається переважно положення 2. Так, при дії на хінолін натрій амідом у середовищі рідкого амоніаку утворюється 2-амінохінолін, калій гідроксидом при 280—300°С — 2-гідроксихінолін:
2-амінохінолін 2-гідроксихінолін реакції відновлення та окиснення.Відновлення хіноліну проходить в першу чергу в піридиновому ядрі. При дії більшістю відновників з високим виходом утворюється 1,2-дигідрохінолін, у присутності нікелю Ренея хінолін відновлюється воднем до 1,2,3,4-тетрагідрохіноліну. Каталітичного гідрування за жорстких умов зазнає також бензенове кільце:
1,2,3,4-тетрагідрохінолш П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи Окиснення хіноліну та його гомологів із замісниками в бензеновому ядрі дією калій перманганату в лужному середовищі супроводжується розщепленням бензенового кільця і приводить до утворення 2,3-піридиндикарбонової кислоти (хінолінова кислота).
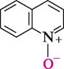
КМпО4; ОН -2СО2; -Н2О ноос хінолінова кислота; 2,3-піридиндикарбонова кислота Хінолін, аналогічно піридину, у присутності пероксикислот окиснюється по гетероатому з утворенням N-оксиду (N-окиснення).
СН3СОООН; 65 °С
XІНОЛІН-N-ОКСИД НАЙВАЖЛИВІШІ ПОХІДНІ ХІНОЛІНУ
Хінолінове ядро є структурним фрагментом деяких алкалоїдів (див. с. 615) і лікарських засобів.
8-Гідроксихінолін.Безбарвна кристалічна речовина (т. пл. 75—76 °C), малорозчинна у воді, розчиняється в хлороформі, у діетиловому етері та бензені. 8-Гідроксихінолін добувають нагріванням о-амінофенолу з гліцерином і сульфатною кислотою в присутності о-нітрофенолу (синтез Скраупа) або сплавленням 8-хінолінсульфокислоти з лугами:
8О3Н ЗШОН (сплавл.) ^ ; -2Н2О (Жа НС1 З іонами металів (Mg2+, Al3+, Zn2+, Mn2+, Co2+, Ni2+, Cu2+, Fe2+, Fe3+ тощо) 8-гідроксихінолін утворює малорозчинні у воді комплекси (хелати). На цій властивості ґрунтується застосування 8-гідроксихіноліну як аналітичного реагенту.
хелатний комплекс Ряд похідних 8-гідроксихіноліну використовують у медичній практиці як протимікробні засоби (хінозол, нітроксолін (5-НОК) тощо). Глава 32
N0 ОН
хінозол; 8-гідроксихіноліній сульфат нітроксолш; 8-гідрокси-5-нітрохінолін Припускають, що їх бактерицидна дія базується на зв'язуванні іонів Co необхідних для життєдіяльності мікроорганізмів. ІЗОХІНОЛІН
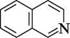
Ізохінолін (бензо[c]піридин) — це ізомер хіноліну. Молекула ізо-хіноліну, як і хіноліну, складається з конденсованих піридинового і бензенового циклів, але, на відміну від хіноліну, цикли з'єднані вздовж зв'язку С-3—C-4 піридинового кільця. Нумерацію атомів ізохінолінового ядра проводять за правилами ШРАС зазначеним способом. СПОСОБИ ДОБУВАННЯ Ізохінолін міститься в хіноліновій фракції кам'яновугільної смоли (близько 1 %), з якої його здобувають у вигляді солі (гідросульфату). Одним з розповсюджених способів синтезу ізохіноліну та його похідних є синтез Бішлера—напиральського(1893 р.), який ґрунтується на циклізації N-ацильних похідних |3-фенілетиламінів у 3,4-дигідроізохіноліни і подальшому перетворенні останніх у ізохіноліни шляхом каталітичного дегідрування. циклізацію N-ацильних похідних здійснюють у присутності P2O5 або POCl3 у ксилені.
К— с СІ
р-фенілетиламін ЇЧ-ацил-р -фенілетиламін
к 1-К-заміщений 3,4-дигідроізохінолін С;Р<і -н,
і-К-заміщений ізохінолін ФІЗИЧНІ ВЛАСТИВОСТІ Ізохінолін — безбарвна кристалічна речовина (т. пл. 24,6°С), розчиняється у воді, в етанолі, у діетиловому етері, хлороформі та бензені. П'яти- та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи ХІМІЧНІ ВЛАСТИВОСТІ За хімічними властивостями ізохінолін мало відрізняється від хіноліну. За рахунок гетероатома ізохінолін виявляє основні та нуклеофільні властивості і легко утворює солі з кислотами, алкіл- та ацилгалогенідами. як основа ізохінолін дещо сильніший за хінолін (рKВН+ ізохіноліну в Н2О — 5,14; рKВН+ хіноліну — 4,94). Реакції електрофільного заміщення в ізохіноліновому циклі подібні до хінолінового і проходять переважно в положеннях 5 і 8.
(конц.); Н28О4 (конц.)
N0
5-нітроізохінолш (~ 90 %) 8О3Н
N0, 8 -нітроізохінолін (~ 10 %) 5-ізохінолінсульфокислага Нуклеофільне заміщення в молекулі ізохіноліну перебуває переважно в положенні 1.
тт2 1-аміноізохінолін
КОН (сплавл.); 200 °С О 1-ізохінолон При відновленні ізохіноліну, як і в молекулі хіноліну, у першу чергу гідрується піридинове ядро. Так, при дії натрієм в етанолі або воднем над нікелевим каталізатором ізохінолін відновлюється до 1,2,3,4-тетрагідроізохіноліну:
1,2,3,4-тетрагідроізохінолін За більш жорстких умов гідруванню піддається і бензенове кільце. При окисненні ізохіноліну лужним розчином KMnО4 утворюється суміш фталевої і 3,4-піридиндикарбонової кислот. Глава 32
КМпО4; ОН -СО2; -Н2О ноос
3,4-піридиндикарбонова кислота Під дією органічних пероксикислот ізохінолін окиснюється по гетероатому, утворюючи N-оксид.
-сн3соон ізохшолш->)-оксид ядро ізохіноліну є структурним фрагментом молекул алкалоїдів ізохінолінового ряду — папаверину, морфіну, кодеїну і т. ін. (див. с. 616—618). АКРИДИН
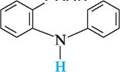
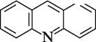
Акридин (дибензо[b,e]піридин) — конденсована система, яка складається з двох бензенових і одного піридинового кілець. Атоми акридинового ядра нумерують, як показано на структурній формулі. Акридин вперше добуто з кам'яновугільної смоли 1870 року німецькими хіміками-органіками Карлом Гребе і Генріхом Каро. СПОСОБИ ДОБУВАННЯ Відомо кілька синтетичних способів добування акридину та його похідних. Конденсація дифеніламіну з карбоновими кислотами(Бернтсен, 1884 р.). При нагріванні дифеніламіну з мурашиною кислотою в присутності цинк хлориду утворюється акридин, конденсація з іншими карбоновими кислотами дозволяє одержати 9-R-заміщені акридини.
' 2пС12; 1
+ Н—С дифеніламін мурашина кислота акридин Циклізація N-фенілантранілової кислоти.У 1933 році був запропонований спосіб одержання акридина і його похідних, побудований на циклізації N-фенілантранілової кислоти за допомогою фосфор трихлороксиду POCl3 (А. М. Григоровський і О. Ю. Магідсон). Реакція проходить через стадію утворення хлорангідриду N-фенілантранілової кислоти і 9-гідроксиакридину. Кінцевим продуктом є 9-хлоракридин.
О
СООН РОСІ, -неї К-фенілантранілова кислота хлорангідрид К-фенілантранілової кислоти П'яти- та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи
9-гідроксиакридин; 9-акридол 9-хлоракридин У молекулі 9-хлоракридину атом Хлору має значну рухливість і може бути легко заміщений на атом Гідрогену, гідрокси-, алкокси- або аміногрупу.
Н2;№
Н2О; і
н^ м
9-гідроксиакридин осн,
9-метоксиакридин *2
К2Сг207 -Н2О акридин 9-аміноакридин Для добування різних похідних акридину з замісниками в бензенових кільцях циклізації піддають відповідні заміщені N-фенілантранілові кислоти. ФІЗИЧНІ ВЛАСТИВОСТІ Акридин — світло-жовта кристалічна речовина з характерним запахом (т. пл. 111 °С), легко сублімується, викликає подразнення шкіри і дихальних шляхів, звідки і походить його назва (лат. acris — їдкий). Він добре розчиняється в етанолі, у діетиловому етері, бензені, малорозчинний у воді. Розведені розчини акридину мають синю флуоресценцію. ХІМІЧНІ ВЛАСТИВОСТІ Акридин — гетероароматична сполука. За участі неподіленої пари електронів атома Нітрогену він виявляє слабкі основні і нуклеофільні властивості та утворює солі із сильними кислотами та алкілгалогенідами: Глава 32
сг н акридиній хлорид N-метилакридиній йодид У реакції електрофільного заміщення акридин вступає дуже важко і неоднозначно. Так, при нітруванні утворюється суміш ізомерних нітроакридинів із вмістом переважно 2-нітроакридину. Реакції нуклеофільного заміщення для акридину проходять достатньо легко в положенні 9. Наприклад, при дії на акридин натрій амідом утворюється 9-аміноакридин.
N11,
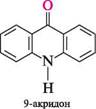
9-аміноакридин Акридинове ядро дуже стійке до окиснення. Під дією калій дихромату в оцтовокислому середовищі акридин окиснюється в 9-акридон, який є таутомерною речовиною та існує в двох формах — гідрокси- і оксоформі.
К2Сг2О7 9-гідроксиакридин У присутності органічних пероксикислот акридин окиснюється по гетероатому з утворенням N- оксиду.
О" акридин-ІЧ-оксид При окисненні в жорстких умовах відбувається часткове руйнування акри-динового ядра, а продуктом окиснення є 2,3-хіноліндикарбонова (акридинова) кислота:
соон КМпО4; ОН -2СО2; -Н2О 2,3-хіноліндикарбонова кислота; акридинова кислота П'яти- та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи Відновлення акридину перебігає аналогічно антрацену, тобто за положеннями 9 і 10. Так, під дією натрію в спиртовому розчині або при каталітичному гідруванні акридин перетворюється в 9,10-дигідроакридин (акридан).
Н2
н 9,10-дигідроакридин; акридан НАЙВАЖЛИВІШІ ПОХІДНІ АКРИДИНУ
9-аміноакридин— жовта кристалічна речовина (т. пл. 236— 237°С), розчиняється в етанолі та ацетоні. 9-Аміноакридин — сильніша основа, ніж акридин. Він містить у своєму складі два основних центри — атом Нітрогену піридинового типу та атом Нітрогену аміногрупи. Однак унаслідок кон'югації аміногрупи з гетероатомом 9-аміноакридин, аналогічно у-амінопіридину, утворює сіль лише по кільцевому Нітрогену.
на СГ 9-амшоакридиній хлорид Деякі похідні 9-аміноакридину застосовуються як лікарські препарати (акрихін, етакридин лактат (риванол) тощо). Акрихін виявляє протималярійну, а етакриди-ну лактат — антисептичну дію. н3с—сн—(сн2)3— ЇЧН „осн
акрихін; 9-(4'-діетиламіно-Г-метилбугиламшо)-2-метокси-6-хлоракридин дигідрохлорид
Поиск по сайту: |




 -8О2; -НС1
-8О2; -НС1 -неї
-неї

 -неї
-неї









 тлі,
тлі,

 Зденко Ханс СКРАУП С6Н5№)2
Зденко Ханс СКРАУП С6Н5№)2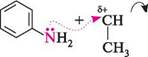
 \
\


 Сґ
Сґ N0,
N0,
 5-нітрохінолін (~ 52 %)
5-нітрохінолін (~ 52 %)





 -сн3соон
-сн3соон





 зо:
зо:

 N11,
N11, -неї
-неї



 Н28О4-5О3
Н28О4-5О3



 (рідк.)
(рідк.)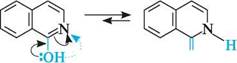












 -неї
-неї -НС1
-НС1 -неї
-неї










 сн,сооон
сн,сооон -сн,соон
-сн,соон