|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Олексій Євгенович ЧИЧИБАБІН (1871-1945)
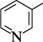
Російський хімік-органік. Закінчив Московський університет (1892). Основні наукові дослідження присвячені хімії нітрогеновмісних гетероциклічних сполук (піридину та його похідних). Відкрив (1906) реакцію ци-клоконденсації альдегідів з амоніаком з утворенням гомологів піридину (реакція Чичибабіна). Розробив (1914) спосіб амінування піридину. Синтезував піридин (1924) взаємодією оцтового, мурашиного альдегідів з амоніаком. Увів поняття про аміно-імінну таутомерію. Досліджував таутомерію аміно- і гідроксипіридинів. Відкрив (1919) явище фототропії в ряді похідних піридину. Установив будову алкалоїдів (пілокарпін, бергенін, антонін). Автор підручника «Основні засади органічної хімії» (1925) (7 видань). 2-амінопіридин Подальше амінування приводить до утворення 2,6-діамінопіридину. Заміщення на аміногрупу атома Гідрогену в у-положенні відбувається тільки в тому разі, якщо а-положення вже зайняті. Уперше цю реакцію здійснив російський хімік-органік Олексій євгенович Чи-чибабін 1914 року, тому вона отримала назву «реакція Чичибабіна», а надалі була поширена і на інші гетероциклічні сполуки. Механізм реакції:
N + 1ЧН2 -н су-комплекс Глава 32 Реакція перебігає за механізмом SN2. На першій стадії нуклеофільна частинка ^Н^) атакує піридинове кільце з утворенням с-комплексу. На другій стадії о-комплекс стабілізується шляхом відщеплення гідрид-іона Н . Аналогічно амінуванню проходить гідроксилювання піридинового циклу. При пропусканні парів піридину над сухим калій гідроксидом при 300—320 °C утворюється 2-гідроксипіридин:
калій 2-піридинолят 2-гідроксипіридин; 2-піридинол реакції відновлення та окиснення. Відновлення. Піридиновий цикл порівняно з бензеновим відновлюється легше. Залежно від природи відновників та умов гідрування утворюються різні продукти. При відновленні піридину воднем у момент виділення (металічний натрій у етанолі) або воднем над платиновим, паладієвим або родієвим каталізатором утворюється піперидин. За досить жорстких умов, наприклад, при високотемпературному каталітичному гідруванні, відбувається відновне розщеплення піридинового кільця по зв'язку C—N з утворенням 1-пен-танаміну. + С2Н5ОН)
ЗН2 (Рі; Рсі або Юі)
4Н2 (N1; 180 °С) СН 2 СН2 СН2 СН2 СН2 1-пентанамін Окиснення. Піридинове кільце стійке до дії окисників. Алкілпіридини, подібно до алкілбензенів, окиснюються досить легко, утворюючи відповідні піридинкарбонові кислоти.
Р-піколін нікотинова кислота Під дією пероксикислот піридиновий цикл окиснюється по атому Нітрогену з утворенням N-оксидів (N-окиснення):
+ сн3-с( о-н пероксиоцтова кислота О" піридин-Т^-оксид Піридин-N-оксид і його похідні досить легко відновлюються до вихідних піри-динів. як відновні агенти частіше використовують галогеніди фосфору(III). П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи
г + РС1, N + РОСІ,
Піридин-N-оксид, на відміну від піридину, більш активний у реакціях електрофільного заміщення. це зумовлено деяким електронодонор-ним ефектом атома Оксигену. На атомах Карбону в а- і у-положеннях молекули піридин-N- оксиду, унаслідок зміщення електронної густини від атома Оксигену в кільце, електронна густина підвищена порівняно з піридином. Так, піридин-N-оксид вступає в реакцію нітрування набагато легше, ніж піридин. При нітруванні нітратною кислотою або калій нітратом у сульфатній кислоті з високим виходом утворюється 4-нітропіридин-N-оксид.
НО—
4-нітрошридин-К-оксид Оскільки заміщений N-оксид може бути відновлений до відповідного піридину, цю реакцію використовують для добування у-заміщених піридину.
N0,
8Н;№
на
4-штропіридин N11
4-хлоропіридин-ІЧ-оксид 4-хлоропіридин Алкілювання та ацилювання N- оксидів перебігає по атому Оксигену з утворенням солей N-алкокси- і N-ацилоксипіридинію відповідно. Глава 32
О—С ,0 сн, Сґ
К-метоксипіридиній йодид М-ацетоксипіридиній хлорид Реакції N-оксидів з нуклеофільними реагентами проходять аналогічно піридину, тобто переважно в положенні 2. НАЙВАЖЛИВІШІ ПОХІДНІ ПІРИДИНУ Піколіни. Піколінами називають монометильні похідні піридину. Розрізняють а-піколін (2-метилпіридин), Р-піколін (3-метилпіридин) і у-піколін (4-метилпі-ридин).
СН,
N а-піколін Р-піколін у-піколін Піколіни — безбарвні рідини з неприємним піридиноподібним запахом, добре розчиняються у воді та органічних розчинниках. Температура кипіння а-піколіну — 129,5°C, Р-піколіну — 144°C, у-піколіну — 145,4°С. Хімічні властивості піколінів і піридину подібні. як і піридин, метилпіриди-ни утворюють солі із сильними кислотами та алкілгалогенідами, окиснюються пероксикислотами до N- оксидів, відновлюються воднем у присутності Pt або Pd з утворенням похідних піперидину. Під дією окисників — KMnО4, HNO3 або киснем повітря в присутності V2O5 а-, Р- і у-піколіни окиснюються відповідно до піридинкарбонових кислот — піколінової, нікотинової та ізонікотинової кислот (див. с. 570).
[ 1 N
піколіни піридинкарбонові кислоти Унаслідок електроноакцепторного впливу гетероатома в молекулах а- і у-ттіколінів атоми Гідрогену метильних груп мають підвищену рухливість. Саме тому в процесі депротонування аніони, які утворюються, стабілізуються шляхом делокалізації негативного заряду по кон'югованій системі, яка включає гетероатом:
П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи Тому а- і у-піколіни, на відміну від Р-піколіну, вступають у реакцію конденсації з альдегідами та кетонами, при дії натрій аміду NaNH2 або феніллітію C6H5Li утворюють метал органічні сполуки, взаємодією яких з алкілгалогенідами одержують гомологи піридину.
С6Н5—С^ ; 2пС12; 180 °С н Ч СН--- СН СгНд
1 - (а-піридил)-2-фенілетен; о. -стирилшридин
гШ,
сн2—сн3 піридил-2-метилнатрій 2-етилпіридин Піколіни використовують в органічному синтезі. а-Піколіни застосовують у виробництві пестицидів, Р- і у-піколіни — для одержання нікотинової та ізо-нікотинової кислот відповідно (див. с. 576). Гідроксипіридини(оксипіридини, піридиноли). Залежно від положення гід-роксигрупи в піридиновому циклі розрізняють а-гідроксипіридин (2-гідрокси-піридин, 2-піридинол), Р-гідроксипіридин (3-гідроксипіридин, 3-піридинол), у-гідроксипіридин (4-гідроксипіридин, 4-піридинол).
он а-гідроксипіридин р-гідроксипіридин у-гідроксипіридин Гідроксипіридини — безбарвні кристалічні речовини (т. пл. 2-гідроксипіриди-ну — 107°C, 3-гідроксипіридину — 130°C, 4-гідроксипіридину — 151°C), легко розчиняються в етанолі, ацетоні, помірно — у воді, обмежено — у діетиловому етері та бензені. а- і у-Гідроксипіридини — таутомерні сполуки. Вони існують у двох таутомерних формах — гідрокси- та оксоформі. У водному розчині ці сполуки перебувають переважно в оксо-, або так званій піридоновій, формі, у неполярних розчинниках та в газовій фазі переважає гідроксиформа.
—Н
2-гідроксипіридин (гідроксиформа) Р-Гідроксипіридин у водному розчині існує в нейтральній і біполярній формах, які знаходяться в співвідношенні 1:1. Глава 32
нейтральна форма н біполярна форма Гідроксипіридини — біфункціональні сполуки. По гетероатому вони виявляють властивості піридину, по гідроксигрупі — властивості фенолу. Фенольний характер найбільш виражений у 3-гідроксипіридину, гідроксильна група якого не кон'югована з гетероатомом. Так, усі гідроксипіридини утворюють з водним розчином ферум(III) хлориду типове для фенолів пурпурне забарвлення (у 2-і 4-гідроксипіридинів колір менш інтенсивний, ніж у 3-гідроксипіридину). Реакції електрофільного заміщення (нітрування, сульфування, бромування) у 2- і 4-гідро-ксипіридинів проходять у положеннях 3 і 5, що є |3-положеннями піридинового циклу, та орто-, пара -положеннями відносно гідроксигрупи. 3-Гідроксипіридин вступає в аналогічні реакції SЕ в положенні 2.
. ОН ОН он 2- і 4-Гідроксипіридини з алкілгалогенідами утворюють N-алкілпіридони, а 3-гідроксипіридин — солі N-алкілпіридинію:
-ні О ОН СН3-І
Сн, Сн,
2-піридинол ІЧ-метил-2-шридон 3-піридинол К-метил-3-гідрокси-піридиній йодид Багато похідних гідроксипіридинів використовуються в медицині. Представник цієї групи сполук— піридоксин [3-гідрокси-4,5-ди(гідроксиметил)-2-метилпіридин] (вітамін B6). Вітамін B6 міститься в неочищених зернах злаків, в овочах, м'ясі, рибі, молоці, яєчному жовтку тощо. Він відіграє важливу роль в обміні речовин. В організмі піридоксин перетворюється в піридоксаль-5-фосфат, який з деякими білками утворює піридоксалеві ферменти, що здійснюють декарбоксилювання та переамі-нування амінокислот. Використовується піридоксин у вигляді солі з хлоридною
кислотою при В6-гіповітамінозі, токсикозах, анеміях, лей-копеніях і захворюваннях нервової системи.
амінопіридини.Залежно від положення аміногрупи в піридиновому циклі розрізняють а-амінопіридин (2-амінопі-ридин, 2-піридинамін), Р-амінопіридин (3-амінопіридин, 3-піридинамін) і у-амінопіридин (4-амінопіридин, 4-піри-динамін). П'яти- та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи Амінопіридини — безбарвні кристалічні речовини (т. пл. а-амінопіридину — 58°C, Р-амінопіридину — 64°C, у-амінопіридину — 159°C), легко розчиняються у воді, етанолі, діетиловому етері та інших органічних розчинниках.
]ЧН2 N N а-амшопіридин р-амінопіридин у-аміноігіридин Амінопіридини — сильніші основи, ніж піридин і анілін. Вони містять у своєму складі два основних центри — атом Нітрогену піридинового циклу та атом Нітрогену аміногрупи. Разом з тим а- і у-аміїїопіридини, на відміну від Р-аміїїопіридину, утворюють солі тільки з одним еквівалентом мінеральної кислоти (по гетероатому). це зумовлено тим, що в молекулах а- і у-аміїюпіридинів аміногрупа перебуває в кон'югації з гетероатомом і значною мірою втрачає основні властивості, беручи участь у делокалізації позитивного заряду катіона піридинію, який утворюється.
+ на сг 4-амінопіридин 4-амінопіридиній хлорид У молекулі Р-аміїюпіридину аміногрупа не кон'югована з гетероатомом, тому солеутворення проходить по двох основних центрах.
V* + 2НС1 н 2СҐ
З-амшопіридин З-амшопіридин дигідрохлорид; 3-амошопіридиній дихлорид а- і у-Амінопіридини — таутомерніречовини. Вони існують у двох таутомерних формах — амінній та імінній. Більш стійкою є аміноформа.
а - амшошридин
у- амшопіридин Реакційна здатність амінопіридинів залежить від положення аміногрупи в піридиновому кільці. 3-Амінопіридин виявляє властивості, характерні для ароматичних амінів. За участі аміногрупи він вступає в реакції алкілювання, ацилювання, діазо- Глава 32 тування. 2- і 4-Aмінопіридини в звичайних умовах солей діазонію не утворюють, з галогеналканами реагують по атому Нітрогену піридинового кільця.
N Г 2-аміно-1 -метил-шридиній йодид Для амінопіридинів характерні реакції електрофільного заміщення по піридиновому кільцю (сульфування, галогенування, нітрування). а-Амінопіридин у реакціях SЕ утворює продукти заміщення переважно в положенні 5, Р-амінопіридин — у положенні 2, у-амінопіридин — у положенні 3.
Е Таким чином, електрофільне заміщення проходить в орто- або пара -положеннях відносно аміногрупи. Амінопіридини використовують в синтезі лікарських засобів. Піридинкарбонові кислоти. Залежно від положення карбоксильної групи в піридиновому циклі розрізняють а-, Р- і у-піридинкарбонові кислоти. а-Піридинкарбонову кислоту (2-піридинкарбонову кислоту) частіше називають піколіновою кислотою, Р-піридинкарбонову (3-піридинкарбонову) — нікотиновою, у-піридинкарбонову (4-піридинкарбонову) — ізонікотиновою.
піколінова кислота нікотинова кислота ізонікотинова кислота Піридинкарбонові кислоти — безбарвні кристалічні речовини (т. пл. пі-колінової кислоти — 136—137 °C, нікотинової — 236—237 °C, ізонікотино-вої — 323—325 °C). Піридинкарбонові кислоти є біфункціональними сполуками. По карбоксильній групі вони утворюють солі, галогенангідриди, естери, аміди, гідразиди та інші функціональні похідні. По піридиновому кільцю проходять реакції, властиві піридину. Унаслідок наявності в структурі молекул кислотного та основного центрів піридинкарбонові кислоти — амфотерні сполуки. ХООН СООН
СІ"
натрій нікотинат 3-карбоксипіридиній хлорид П'яти- та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи У кристалічному стані і частково в розчинах вони існують у вигляді внутрішньої солі (цвітер-іонів).
Н
Поиск по сайту: |




 КОН; і
КОН; і -Н,
-Н,







 N0,
N0,
 -Н20
-Н20 РС1,
РС1, -РОСІ,
-РОСІ,

 N0,
N0, -ЗН2О
-ЗН2О -н>го2
-н>го2











 -гга3
-гга3
 он ,он
он ,он


 '.О—Н ГОх
'.О—Н ГОх
 О"
О"


 .
.


 ОН
ОН












 КН2 1 ,Е
КН2 1 ,Е
 СООН
СООН хоон
хоон