 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ШЕСТИЧЛЕННІ ГЕТЕРОЦИКЛИ З АТОМОМ ОКСИГЕНУ
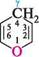
А-ПІРАН І у-ПІРАН а-Піран (2H-піран) і у-піран (4H-піран) — шестичленні гетероциклічні сполуки, що містять як гетероатом один атом Оксигену. Глава 32
а-шран; 2Н-піран у-тран; 4Н-піран ці гетероцикли — структурні ізомери і відрізняються один від одного розміщенням метиленової групи відносно гетероатома. У молекулі а-пірану метиленова група знаходиться в а-положенні, у у-пірану — відповідно в у-положенні. В а- і у-піранів відсутня замкнена кон 'югована система, через що ці речовини не мають ароматичності і характеризуються низькою стабільністю. а-Шран у вільному стані не здобуто. у-Піран виділено у вигляді індивідуальної речовини, але він, як дуже нестійка сполука, легко розкладається на повітрі. Проте оксопохідні піранів — а-пірон (2H-пірон) і у-пірон (4Н-пірон) — достатньо стійкі речовини.
а-Пірон — безбарвна рідина з запахом свіжого сіна (т. кип. 206—209°С), у-пірон — безбарвна кристалічна речовина (т. пл. 33°С).
а- і у-Пірони мають у своєму складі шестичленний гетероцикл, що містить атом Оксигену і 5 атомів Карбону, які перебувають в sp2-гібридизації. Неподілена пара електронів гетероатома взаємодіє з я-електронами двох подвійних зв'язків циклу і карбонільною групою. Делокалізацію електронної густини можна показати у вигляді двох граничних резонансних структур, одна з яких — кон'югований дієн, а інша — ароматична система, подібна до піридину.
О"
+0 О" Тому а- і у-пірони здатні вступати як у реакції, характерні для кон'югованих дієнів, так і в реакції, властиві аренам. а-Пірон вступає переважно в реакції першого типу, тобто цей гетероцикл слід розглядати скоріше як ненасичений лактон. По лактонному угрупованню ( ) ) -пірон вступає в реакції нуклео- О О фільного приєднання, що супроводжуються розкриттям циклу. Так, у присутності лугів а-пірон легко гідролізується, під дією амоніаку розкриття циклу супроводжується рециклізацією з утворенням 2-піридону.
сн=сн—сн=сн—< :о—н
-н2о н 2-піридон .0 он П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи Ненасичений характер а-піронового циклу підтверджується його здатністю до каталітичного гідрування і взаємодії з малеїновим ангідридом в умовах реакції Дільса — Альдера як 1,3-дієна. у-Пірон у результаті кон'югації неподіленої пари електронів гетероатома з карбонільною групою не утворює характерних для кетонів похідних по карбонільній групі (оксимів, гідразонів, основ шиффа) і важко вступає в реакції приєднання за місцем розриву подвійних вуглець-вуглецевих зв'язків. у-Пірон при взаємодії з мінеральними кислотами (НС1, НСЮ4) або алкілгалогенідами утворює солі пірилію.
сг 4-гідроксипірилій хлорид 4-метоксипірилій йодид Пірилієвий катіон у солях пірилію містить замкнену шести-я-електронну систему і, подібно до бензену або піридину, має ароматичний характер. Реакції у-пірону з нуклеофільними реагентами, аналогічно а-пірону, переважно супроводжуються розкриттям циклу за місцем розриву зв'язку O—C. У присутності амоніаку у-пірон перетворюється в у-піридон. Деякі похідні у-пірону є природними речовинами. До них належать хелідонова і меконова кислоти. Хелідонова кислота міститься в траві чистотілу (Chelidonium majus), меконова кислота виділена з маку снотворного (Papaver somniferum).
ОН хелідонова кислота; у-пірон-2,6-дикарбонова кислота меконова кислота; 3-гідрокси-у-пірон-2,6-дикарбонова кислота КУМАРИН
Синтетично кумарин добувають за реакцією Перкіна (див. с. 398) конденсацією саліцилового альдегіду з оцтовим ангідридому присутності натрій ацетату.
180 °С
+ (СН3СО)2О саліциловий альдегід кумарин Глава 32 Хімічні властивості кумарину зумовлені наявністю в його структурі лактонного і бензенового кілець. Реакції з нуклеофільними реагентами проходять по лактон-ному кільцю і зазвичай супроводжуються розкриттям циклу. Так, при нагріванні кумарину з водним розчином лугу утворюється сіль о-гідроксикоричної кислоти. Після підкислення розчину відбувається швидка рециклізація в кумарин.
2НС1
СШа
кумарин динатрієва сіль кумаринової кислоти По бензеновому кільцю кумарин вступає в реакції електрофільного заміщення (нітрування, сульфування). електрофільній атаці в першу чергу піддається положення 6.
НО,8 6-нітрокумарин б-кумаринсульфокислота Похідні кумарину містяться в багатьох рослинах і мають фармакологічну активність. Деякі речовини з групи 4-гідроксикумаринів виявляють виражену антикоагулянтну дію, тобто знижують згортання крові. На їх основі створені анти-коагулянтні лікарські препарати (неодикумарин, фепромарон, синкумар тощо), які використовуються для профілактики і лікування тромбозів.
неодикумарин; етиловий естер ди-(4-гідрокси-кумаришл-3)оцгової кислоти фепромарон; 4-гідрокси-3-(3' -оксо- Г -феніл-пентил)кумарин 32.7.3. ХРОМОН
Хромон (бензо[b]піран-4-он, 4-хроменон) — конденсована гетероциклічна система, що складається з бензенового і у-піронового циклів. За хімічними властивостями хромон нагадує у-пірон. Подібно до у-пірону, при обробці сухим хлороводнем в етері хромон утворює сіль бензопірилію, під дією водних розчинів лугів відбувається розкриття у-піронового кільця по зв'язку O—C-2. Хромон і його похідні широко розповсюджені в рос- П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи линному світі і містяться в багатьох вторинних метаболітах рослин. Найважливіші похідні хромону — флавон (2-фенілхромон) та ізофлавон (3-фенілхромон):
флавон ізофлавон Похідні флавону та ізофлавону належать до великої групи природних сполук — флавоноїдів. У рослинах дуже поширені гідроксипохідні флавону — флавоноли. Природні флавоноли завжди містять гідроксигрупи в положеннях 5 і 7, іноді — у положенні 3 і, як правило, у положеннях 3' і 4'. Вони забарвлені в жовтий колір і є барвними пігментами жовтих квітів. Представники флавонів — лутеолін і кверцетин.
кверцетин он У рослинах вони знаходяться у вигляді глікозидів. Глікозид кверцетину з дисахаридом, побудованим з D-глюкози і L-рамнози, називають рутином. У медичній практиці рутин застосовують як засіб, що має Р-вітамінну активність. Структуру хромону покладено в основу лікарського препарату «Інтал», який використовується для лікування бронхіальної астми.
ОН інтал; кромолін-натрій
Поиск по сайту: |








 "с—сн,—сн=сн—с
"с—сн,—сн=сн—с О
О
 осн,
осн,
 О О
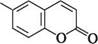
О О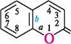 Кумарин (бензо[b]піран-2-он, 2-хроменон) — конденсована гетероциклічна система, що складається з бензенового і а-піронового циклів. За будовою кумарин — це лактон цис-о-гідроксикоричної кислоти (кумаринова кислота). Він зустрічається в багатьох рослинах. Маючи запах свіжоскошеного сіна, кумарин надає аромату буркунові, маренці та іншим рослинам.
Кумарин (бензо[b]піран-2-он, 2-хроменон) — конденсована гетероциклічна система, що складається з бензенового і а-піронового циклів. За будовою кумарин — це лактон цис-о-гідроксикоричної кислоти (кумаринова кислота). Він зустрічається в багатьох рослинах. Маючи запах свіжоскошеного сіна, кумарин надає аромату буркунові, маренці та іншим рослинам.
 ,0
,0
 о т>
о т>




 лутеолін
лутеолін
 о о—сн2—сн—сн2—о о
о о—сн2—сн—сн2—о о