|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Роберт Бернс ВУДВОРД (1917-1979)
Американський хімік-органік. Найбільший фахівець у галузі синтетичної і структурної органічної хімії. Разом зі співробітниками й учнями здійснив синтези: хініну (1944), семперверину (1949), холестеролу і кортизону (1951), стрихніну і ланостерину (1954), резерпіну (1956), хлорофілів аі (3 (1960), вітаміну В12 (1971). Значний його внесок у встановлення структур складних органічних сполук (пеніцилін, патулін, тераміцин, біоміцин, стрептоміцин). Установив (1952) сендвічеву структуру дицикло-пентадієнілферуму і назвав його фе-роценом. Лауреат Нобелівської премії (1965). ГЛ --У
о І- (5-нітрофурфуршііден)аміно] -2-оксазолідон; фуразолідон Препарати нітрофуранового ряду виявляють високу антибактеріальну активність. Вони широко використовуються в медицині для лікування гнійних і запальних процесів. Особливо цінна властивість цих препаратів у здатності в ряді випадків бути ефективними проти форм збудників, стійких до сульфаніламідів і антибіотиків. ІНДОЛ
П'яти- та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи СПОСОБИ ДОБУВАННЯ Індол міститься в невеликих кількостях (3—5 %) у кам'яновугільній смолі, звідки може бути виділеним у чистому вигляді. Індол та його гомологи можна здобути різними синтетичними методами. Циклізація N-форміл-о-толуїдину. Реакція перебігає в присутності сильної основи (калій трет-бутаноляту або натрій аміду) і належить до реакцій конденсації кротонового типу.
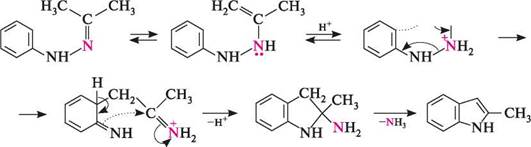
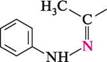
К-форміл-о-толущин індол Перегрупування фенілгідразонів альдегідів або кетонів у присутності кислотного каталізатора (метод Фішера). цей спосіб застосовують для синтезу гомологів індолу з алкільними замісниками в пірольному ядрі. Реакція перебігає при нагріванні фенілгідразонів альдегідів (за винятком формальдегіду та ацетальдегіду) або кетонів у присутності сульфатної кислоти чи цинк хлориду:
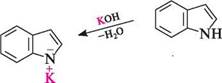
ацетон фенілгідразон Механізм реакції: СН, -N11, 2-метиліндол 8+ Н2^С/СН3 ФІЗИЧНІ ВЛАСТИВОСТІ Індол — безбарвна кристалічна речовина (т. пл. 52°С), що має своєрідний неприємний запах. Добре розчинний у етанолі, етері та толуені, практично не розчинний у воді. У малих концентраціях індол має приємний квітковий запах. ХІМІЧНІ ВЛАСТИВОСТІ Індол — гетероароматична сполука. За хімічними властивостями він нагадує пірол. Під дією мінеральних кислот індол осмоляється, що вказує на його ацидо-фобність. Подібно до піролу, у реакціях із сильними основами (лужними мета- Глава 32 лами, лугами, алкоксидами металів, магнійорганічними сполуками) індол виявляє властивості слабкої NH-кислоти (рКа = 16,97).
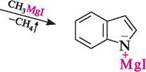
індолкалій індолмагній йодид Металічні похідні індолу широко використовують в різних синтезах. У реакціях електрофільного заміщення в молекулі індолу більш реакцій-ноздатним є гетероциклічне кільце, але на відміну від піролу замісник направляється в ^-положення. це можна пояснити тим, що утворення с-комплексу за Р-положенням для індолу більш вигідний процес (порівняно з а-положенням), оскільки в цьому випадку позитивний заряд може бути делокалізований без порушення ароматичної системи бензенового ядра. Унаслідок електрофільної атаки а-положення утворюється с-комплекс, в якому делокалізація позитивного заряду може бути здійснена лише з порушенням ароматичної системи бензенового кільця, що енергетично для молекули не вигідно.
Е+ якщо |3-положення зайняте, то електрофільне заміщення відбувається в а-положенні. Так, при нітруванні індолу бензоїлнітратом, сульфуванні піри-динсульфотриоксидом, галогенуванні сульфурилхлоридом та азосполученні утворюються відповідні Р-заміщені продукти:
С6Н5СООМО2
[€^N=N10- 3-бензеназоіндол При відновленні індолу воднем у присутності платинового каталізатора утворюється 2,3-дигідроіндол:
П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи
Поиск по сайту: |
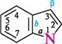 Молекула індолу (бензо[b]піролу) — конденсована гетероциклічна система, що складається з пірольного і бензенового кілець. Нумера- цію атомів в індолі починають з гетероатома, атоми Карбону в пі-Н рольному циклі позначають також літерами а, і(3.
Молекула індолу (бензо[b]піролу) — конденсована гетероциклічна система, що складається з пірольного і бензенового кілець. Нумера- цію атомів в індолі починають з гетероатома, атоми Карбону в пі-Н рольному циклі позначають також літерами а, і(3.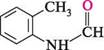




 -С6Н5СООН
-С6Н5СООН
 Н2(РІ) ^
Н2(РІ) ^