 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Взаємодія гідразину, алкіл- або арилгідразинів з 1,3-дикарбонільними сполуками.
цей спосіб застосовують для добування гомологів піразолу. Так, при взаємодії гідразину з ацетилацетоном утворюється 3,5-диметилпіразол: ЄН, / 3 / 7 О // \\ /-, + Н2К NН2 ► г1 хг + 2Н00 н ацеталацетон; 3,5-диметилпіразол 2,4-пентандіон Глава 32 ФІЗИЧНІ ВЛАСТИВОСТІ Піразол— безбарвна кристалічна речовина зі слабким запахом піридину (т. пл. 70°C, т. кип. 187°C), добре розчиняється у воді, в етанолі, етері. У неполярних розчинниках існує у формі димерів і тримерів за рахунок утворення міжмолекулярних водневих зв'язків.
н І N 8+
димер шразолу тример шразолу ХІМІЧНІ ВЛАСТИВОСТІ Кислотність і основність.Кислотно-основні властивості піразолу зумовлені наявністю в його структурі атомів Нітрогену пірольного і піридинового типів.
Н піразол атом Нітрогену пірольного типу атом Нітрогену піридинового типу
піразолій хлорид СІ" шразол калій піразолід Солі піразолу — досить стійкі сполуки. їх стабільність зумовлена делокаліза-цією позитивного заряду в катіоні піразолію або негативного заряду в піразолід-аніоні між всіма атомами циклу. П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи
Наявність у молекулі піразолу рухливого атома Гідрогену ІЧН-групи та основного центру — атома Нітрогену піридинового типу є причиною виявлення про-тотропної, або так званої азольної, таутомерії. Прототропна таутомерія піразолу та його гомологів зумовлена міграцією протона від NH-групи до атома Нітрогену піридинового типу.
Н Унаслідок таутомерних перетворень положення 3 і 5 у молекулі піразолу рівноцінні. Так, 3-метилпіразол і 5-метилпіразол є таутомерними формами однієї і тієї ж сполуки:
3(5)-метилігіразол При цьому міграція протона Н+ відбувається настільки швидко, що виділити індивідуальні таутомери неможливо. Тому в назвах таких сполук поряд з цифрою, яка вказує положення замісника, у дужках наводиться цифра, що позначає можливість відліку від іншого, хімічно ідентичного атома Нітрогену. Так, зазначену вище сполуку називають 3(5)-метилпіразолом. реакції з електрофільними реагентами.Через електроноакцепторний вплив атома Нітрогену піридинового типу реакційна здатність піразолу з електрофільними реагентами знижена. Напрям реакцій SE залежить від природи атакуючого реагенту та умов їх проведення. Алкілювання та ацилювання піразолу відбувається зазвичай з утворенням продуктів N-заміщення. Так, при взаємодії піразолу з йодометаном у нейтральному або лужному середовищі утворюється N-метилпіразол:
сн3—і N
Н шразол н М-металпіразолій йодид ІЧ-метилпіразол Спочатку електрофільний реагент CH3I атакує атом Нітрогену піридинового типу молекули піразолу з утворенням солі — N-метилпіразолій йодиду, яка Глава 32 відщеплює HI, утворюючи кінцевий продукт реакції. ця реакція перебігає з переносом реакційного центру. Аналогічно відбувається ацилювання піразолу. Реакції піразолу із сильними електрофільними реагентами (нітрування, сульфування, галогенування) відбуваються з утворенням продуктів заміщення по атому Карбону в положенні 4 (найбільш віддаленому від атомів Нітрогену). Оскільки піразол не виявляє ацидофобних властивостей, нітрування і сульфування його проводять концентрованими нітратною і сульфатною кислотами відповідно. Обидві реакції перебігають через стадію утворення неактивного катіона піразолію.
НЖ>3 (конц.); і
4-штропіразол
// \\ н 4-піразолсульфокислота Галогенування піразолу проходить порівняно легко.
І І \\ '. ^ч + на
н 4-хлороігіразол реакції відновлення.При відновленні піразолу воднем у момент виділення (C2H5OH + Na) утворюється частково гідрований продукт — 2-піразолін. Гідрування в присутності каталізатора приводить до утворення повністю відновленої похідної — піразолідину. 2Н (N8 + С2Н5ОН)
NН
2-піразолін; 3,4-дигідропіразол
2Н2 (РІ) н піразолідин; тетрагідроігіразол П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи Піразолін і піразолідин — набагато сильніші основи, ніж піразол. Вони виявляють властивості вторинних аліфатичних амінів. НАЙВАЖЛИВІШІ ПОХІДНІ ПІРАЗОЛУ
5-Піразолон(2-піразолін-5-он). Безбарвна кристалічна речовина (т. пл. 165°C), добре розчиняється у воді, в етиловому спирті, погано — в етері, толуені. 5-Піразолон — таутомерна сполука і може існувати в CH2-, OH- та NH-формах:
нсг не—сн /4 ^ О' нс=сн /4 5\ С3 ^ 4
(СН2-форма) 5-піразолон (ОН-форма) 5-гідроксипіразсш (NН-форма) 3-піразолон У зазначеній рівновазі істотно переважає CH2-форма, тому в назві сполуки віддають перевагу 5-піразолону. ядро 5-піразолону входить у структуру ряду лікарських препаратів (антипірину, амідопірину, анальгіну). як вихідну речовину для виготовлення лікарських препаратів піразолонового ряду використовують 3-метил-1-феніл-5-піразолон. Уперше сполука була синтезована 1883 року німецьким хіміком-органіком людвігом Кнор-ром з ацетооцтового естеру і фенілгідразину: СН, н2с-с% о ОС2Н5 С6Н5— ТШ—N11,
о н2/с- ■я N юо-с (ґ сн н2с—с \ з
ацетооцтовий естер фешлгідразон ацетооцтового естеру 3-метил-1 -феніл-5-піразолон 3-Метил-1-феніл-5-піразолон, подібно до незаміщеного 5-піразолону, може існувати в трьох таутомерних формах:
НО
СН2-форма ОН-форма Ші-форма Установлено, що в неполярних розчинниках переважає CH2-форма, а у водних розчинах — NH-форма. При взаємодії 3-метил-1-феніл-5-піразолону (у NH-формі) з метилйодидом утворюється 2,3-диметил-1-феніл-5-піразолон (антипірин, феназон).
Людвіг КНОРР (1859-1921) Німецький хімік-органік. Основні наукові праці присвячені вивченню кето-енольної таутомерії і синтезам на основі ацетооцтового естеру. Відкрив і вивчив (1883) клас піразолів. Розробив метод їх одержання на основі циклоконденсації (3-дикарбонільних сполук з гідразинами. Здійснив синтез антипірину (1883), морфоліну (1889). Розробив (1884) метод одержання піролів. Вивчав (з 1889) будову алкалоїдів — кодеїну, морфіну, тебаїну тощо. Президент Німецького хімічного товариства (1915—1916). Сн,
Н -ні 3-метил-1-фешл-5-піразолон 2,3-диметил-1-феніл-5-піразолон; антипірин; феназон антипірин(феназон) — безбарвна кристалічна речовина (т. пл. 114°C), гіркувата на смак, добре розчиняється у воді. Використовується в медицині як жарознижуючий і болезаспокійливий засіб. У молекулі антипірину атом Гідрогену при атомі Карбону в четвертому положенні піразолінового циклу має значну рухливість. При дії нітритної кислоти він легко заміщується на нітрозогрупу. Подальше відновлення 4-нітрозоантипірину, що утворився, дає 4-аміноантипірин — вихідний продукт у синтезі амідопірину та анальгіну. Сн,
антипірин
гг=Ч N 4-нітрозоантипірин 4-амшоантипірин
Амідопірин одержують метилюванням 4-аміноантипірину:
2СН3—І -2НІ 4- аміноантипірин амідопірин; 2,3-диметил-4-диметиламіно-1-фенш-5-піразолон П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи
,сн, сл
СН3 (СН3)28О4
4-амшоантипірин сн 3\ 4-бензиліденамшоантипірин
-Н20 4-метиламіноантипірин анальгін; метамізолнатрій; натрій 2,3-диметил-4-метиламіно-1 -феніл-5-піразолон-5К-метансульфонат Амідопірин і анальгін (метамізолнатрій) використовують у медицині як жарознижуючий і болезаспокійливий засоби, причому в амідопірину сильніше виражена жарознижуюча дія, в анальгіну — болезаспокійлива. ІМІДАЗОЛ
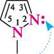
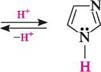
Імідазол (1,3-діазол) — це ізомер піразолу і являє собою гетероарома- тичну систему, в якій атоми Нітрогену (пірольного та піридинового типів) перебувають у положенні 1 і 3. СПОСОБИ ДОБУВАННЯ Імідазол та його похідні найчастіше добувають взаємодією 1,2-дикарбонільних сполук, амоніаку та альдегідів. Імідазол синтезують із гліоксалю, амоніаку та формальдегіду: н гліоксаль
формалвдегід СВ. V І н імідазол ЗН,0 ФІЗИЧНІ ВЛАСТИВОСТІ Імідазол— безбарвна кристалічна речовина (т. пл. 90°C, т. кип. 256°С), добре розчинна у воді, в етанолі, етері. У неполярних розчинниках імідазол утворює міжмолекулярні водневі зв'язки, причому, на відміну від піразолу, асоціати мають лінійну структуру: Глава 32 ХІМІЧНІ ВЛАСТИВОСТІ За реакційною здатністю імідазол має багато спільного з піразолом. Подібно до піразолу, є амфотерною сполукою, виявляючи за рахунок атома Нітрогену пірольного типу слабкі кислотні властивості, а атома Нітрогену піридинового типу — основні.
№ \\ V імідазолщ-атон імідазол імідазолій-катіон Однак імідазол порівняно з піразолом — сильніша основа (рКВН+ = 7,03). Аналогічно піразолу, для імідазолу та його гомологів характерна прототропна (азольна) таутомерія, унаслідок чого положення 4 і 5 імідазольного циклу рівноцінні:
4(5) -метилімідазол Слід зазначити, що електроноакцепторні замісники (—NO2, —SO3H, —Cl тощо) зміщують таутомерну рівновагу вбік 4-заміщеного ізомеру. Подібно до піразолу імідазол вступає в реакції з електрофільними реагентами. Так, реакції алкілювання та ацилювання імідазолу перебігають з переносом реакційного центру: СН,
8- СН3—Вг Вг -НВг N
Н імідазол н ІМ-метилімідазолій бромід N-метилімідазол Нітрування і сульфування відбувається переважно в положеннях 4 і 5 імідазольного циклу. ці реакції проходять дуже важко внаслідок утворення в кислому середовищі малоактивного катіона імідазолію. П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи СШ НЖ>3 (конц.)
№ Н імідазол Н+ н / —N Н імідазошй-катіон -Н3О+ Н28О4 (конц.) N н 4-нітроімідазол Н0,5
ЗВг„ Вг + ЗНВг
н 2,4,5-трибромімідазол Імідазольний цикл досить стійкий до дії окисників (кисню, калій перманганату тощо) і відновників. Проте під дією пероксидів відбувається руйнування циклу з утворенням оксаміду.
н °"С~ - діамід щавлевої кислоти; оксамід НАЙВАЖЛИВІШІ ПОХІДНІ ІМІДАЗОЛУ Важливе значення серед похідних імідазолу мають такі природні сполуки, як алкалоїд пілокарпін, а-амінокислота гістидин і біогенний амін — гістамін. Гістидин[а-аміно-|3-(4-імідазоліл)-пропіонова кислота]. До складу багатьох білків входить у L-конфігурації. ,сн2— сн—соон кн2 Хлороводневу сіль гістидину використовують у медицині для лікування гепатитів, виразкової хвороби шлунка і дванадцятипалої кишки. Глава 32
Гістидин перетворюється в гістамін при ферментативному декарбоксилюванні.
N11,, гістидин гістамін
Гістамін[4-(2'-аміноетил)імідазол]. є біогенним аміном, що бере участь у регуляції життєво важливих функцій організму. Зазвичай гістамін перебуває в організмі у вигляді неактивних лабільних комплексів з білками. При деяких патологічних станах (опіки, відмороження, потраплянні в організм хімічних речовин, у тому числі і лікарських препаратів, алергійні захворювання і т. ін.) гістамін виділяється у вільному вигляді. Вільний гістамін має високу активність: викликає спазм гладенької мускулатури, розширює капіляри і збільшує їхню проникність, підсилює секрецію шлункового соку. Відомий ряд лікарських препаратів на основі імідазолу:
клотримазол (антимікотичний, антитрихомонадний засіб) N сн2—сн2—он метронідазол (антибактеріальний, антипротозойний засіб)
(тиреостатичний засіб)
Поиск по сайту: |



 о
о За рахунок атома Нітрогену піридинового типу піразол виявляє основні властивості (рКВН+ = 2,53), за рахунок атома Нітрогену пірольного типу — слабкі кислотні властивості (рКа14). Отже, піразол — амфотерна сполука і здатний вступати в реакції як з мінеральними кислотами, так і з лугами, утворюючи при цьому солі:
За рахунок атома Нітрогену піридинового типу піразол виявляє основні властивості (рКВН+ = 2,53), за рахунок атома Нітрогену пірольного типу — слабкі кислотні властивості (рКа14). Отже, піразол — амфотерна сполука і здатний вступати в реакції як з мінеральними кислотами, так і з лугами, утворюючи при цьому солі: н
н
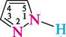

 СН,
СН,
 н
н НО38
НО38 СІ
СІ
 -Н2О
-Н2О

 СНз
СНз



 сн,
сн,
 Анальгін синтезують за схемою:
Анальгін синтезують за схемою: -н2о
-н2о






 ■№
■№

 N
N н2о2> ^'
н2о2> ^'
 ,сн2—сн—соон
,сн2—сн—соон
