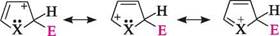|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Юрій Костянтинович ЮР'ЄВ (1896-1965)
Радянський хімік-органік. Закінчив (1925) Московський університет. Основні наукові дослідження проведені в галузі хімії гетероциклічних сполук. Здійснив (1929—1937) каталітичні реакції гідро- і дегідрогенізації N-заміщених піролу, піролідину і де-кагідрохіноліну. Відкрив (1936) і вивчив реакції взаємного каталітичного перетворення піролу, тіофену і селено-фену. Розробив методи синтезу 1,4-ді-оксану, дитіану і тіоксану з етиленоксиду (1945—1950), біс-функціональних похідних фурану. Лауреат Державної премії СРСР (1946).
+
N га
науков ідослід При атомі Нітрогену піридинового типу неподілена пара електронів перебуває на 2-гібридній орбіталі і не бере участь в утворенні ароматичного секстету. За рахунок цієї електронної пари атом Нітрогену піридинового типу здатний приєднувати протон, тобто виявляти основні властивості.
+ Н28О4
піридин піридиній гідросульфат Таким чином, кислотні властивості нітрогеновмісних ароматичних гетероцик-лів зумовлені наявністю в їх структурі атома Нітрогену пірольного типу, а основні — атома Нітрогену піридинового типу. Гетероциклічні сполуки, які містять у своєму складі атоми Нітрогену пірольного і піридинового типів, виявляють амфотерні властивості (піразол, імідазол, пурин тощо).
/7»+ - і Н піразолій хлорид сг натрій піразолід П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи
П'ятичленні гетероароматичні сполуки з одним гетероатомом можна розглядати як похідні бензену, в якому угруповання —CH=CH— заміщене на гетероатом. Найважливішими представниками цієї групи гетероциклів є пірол, фуран і тіофен:
н пірол; фуран; тіофен; азол оксол тіол Назви одновалентних залишків наведених гетероциклів утворюють за допомогою суфікса -ил (-іл), указуючи цифрою або літерою грецького алфавіту положення вільної валентності.
СПОСОБИ ДОБУВАННЯ ЗАГАЛЬНІ СПОСОБИ ДОБУВАННЯ ПІРОЛУ, ФУРАНУ І ТІОФЕНУ Циклізація 1,4-дикарбонільних сполук(синтез Паале—Кнорра).Для добування фурану та його похідних на 1,4-дикарбонільні сполуки діють водовіднімаючими реагентами (концентрована H2SO4, P2O5), для синтезу піролу та його гомологів — амоніаком, для одержання тіофену та його похідних застосовують фосфор пентасульфід P2S5. Н,с—сн, не—сн 2І \2 __ // \\ С С\ +± К—С С—К
00 . он но Взаємні перетворення фурану, піролу та тіофену(цикл реакцій Юр'єва). Реакції взаємних перетворень фурану, піролу та тіофену були відкриті 1936 року російським хіміком-органіком Юрієм Костянтиновичем Юр'євим. При каталітичній дії алюміній оксиду і нагріванні (~450 °С) фуран у присутності амоніаку перетворюється в пірол, а в присутності гідросульфіду — у тіофен. Під дією води за цих же Глава 32 умов пірол і тіофен утворюють фуран. Аналогічно тіофен у присутності амоніаку перетворюється в пірол, а пірол у присутності гідросульфіду — у тіофен.
Слід зазначити, що з наведених реакцій з високим виходом проходять тільки перетворення фурану в пірол і тіофен. СПЕЦИФІЧНІ СПОСОБИ ДОБУВАННЯ Добування піролу.У незначних кількостях пірол міститься в кам'яновугільній смолі. Синтетично його одержують нагріванням діамонійної солі слизової кислоти: Н Н НО.\ //ОН
/ \ ;с с; \ / \ - + -2СО2; -4Н2О; -І н4іїоос чон но7 соокн4 діамонійна сіль слизової кислоти пірол
сукцинімід пірол Добування фурану.У лабораторних умовах фуран добувають сухою перегонкою слизової кислоти. Реакція проходить через стадії утворення дегідрослизової (а,а'-фурандикарбонової) і пірослизової (а-фуранкарбонової) кислот. Н Н нол / .он X------ ОТ А К -зн2о НООС ^^п^" СООН -со2 ноос онно соон слизова кислота дигідрослизова кислота ^л/^ГППМ -т. ** \лл/ -со2 пірослизова кислота фуран П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи У промисловості фуран одержують з альдопентоз. При нагріванні з водовід-німаючими засобами альдопентози циклізуються, утворюючи фурфурол, який окисненням переводять у пірослизову кислоту, і далі, термічним декарбоксилю-ванням,— у фуран:
н н //ОН ■сг \ /Н К \ н -зн2о // н фурфурол [О] ,0
ОН пірослизова кислота фуран Добування тіофену.Тіофен був відкритий випадково 1882 року професором Берлінського університету Віктором Мейєром як домішка в бензені, добутому з кам'яновугільної смоли. У промисловості тіофен одержують у результаті парофаз-ної циклізації бутану із сіркою, а також за реакцією Чичибабіна при пропусканні суміші ацетилену із гідросульфідом над каталізатором Al2O3. . ті.1 Н Н 1.тт . не сн
І % не + сн
..... : V ФІЗИЧНІ ВЛАСТИВОСТІ Пірол — безбарвна рідина з запахом, що нагадує запах хлороформу (т. кип. 130°C). Малорозчинний у воді, добре розчиняється в етанолі та бензені. На повітрі темніє і осмолюється. Фуран — безбарвна рідина зі своєрідним запахом, що нагадує запах хлороформу (т. кип. 32°C). Нерозчинний у воді, добре розчиняється в етанолі і діетиловому етері. Тіофен — безбарвна рідина зі слабким запахом сірчистих сполук (т. кип. 84°C). Нерозчинний у воді, добре розчиняється в етанолі, етері та бензені. Стійкий до дії високої температури. На світлі окиснюється. ХІМІЧНІ ВЛАСТИВОСТІ Реакційна здатність піролу, фурану та тіофену визначається наявністю в їх структурі циклу з п-електрононадлишковою ароматичною системою (шість p-електронів припадає на п 'ять атомів циклу). Проте ступінь ароматичності зазначених гетероциклів нижчий, ніж у бензену, і залежить від природи гетероатома.
532Г Оскільки електронегативність атома Сульфуру менша за електронегативність атомів Нітрогену та Оксигену, частка участі неподіленої пари електронів атома Сульфуру в утворенні ароматичного секстету молекули тіофену більша, ніж атома Нітрогену в піролі та атома Оксигену у фурані. Так, якщо для бензену енергія резонансу становить ~150 кДж/моль, то в ряду пірол, фуран, тіофен вона зменшується у міру збільшення електронегативності гетероатома: тіофен (~130 кДж/моль), пірол (~110 кДж/моль), фуран (~90 кДж/моль). Тому з наведених гетероциклів тіофен за своєю хімічною поведінкою найбільше нагадує бензен, а фуран має найменше виражений ароматичний характер. У деяких реакціях фуран поводиться, як нена-сичена (дієнова) сполука. Унаслідок електронегативності гетероатома в молекулах піролу, фурану та тіофену, на відміну від бензену, електронна густина розподілена нерівномірно, зокрема, на атомах Карбону в о.-положенні густина вища, ніж у ^-положенні, що визначає направленість перебігу реакцій електрофільного заміщення. ЗАГАЛЬНІ ХІМІЧНІ ВЛАСТИВОСТІ ПІРОЛУ, ФУРАНУ ТА ТІОФЕНУ Взаємодія з мінеральними кислотами.У присутності сильних мінеральних кислот пірол і фуран осмоляються, утворюючи полімерні продукти темного кольору. ця властивість отримала назву «ацидофобність», що означає «кислотобоязнь» (від лат. асісіит — кислота і грец. фобос — страх). Ацидофобність зумовлена приєднанням протона, переважно до а-атома Карбону циклу, що приводить до порушення ароматичності кільця. Потім відбувається або розрив циклу з утворенням полімеру (найбільш імовірний процес для фурану), або полімеризація утвореної дієнової структури, яка проходить зі збереженням циклу. Н __/ \/Н _______ поліме- л л м л Н "^ ^Х^Н ~~** ризація X= О; N11 Введення у фуранове та пірольне ядро електроноакцепторних замісників (—NO2, —COOH, —CH=O) приводить до зменшення ацидофобності цих сполук. Тіофен, на відміну від фурану і піролу, не виявляє ацидофобності, оскільки має стійку ароматичну структуру, яка не руйнується при дії сильних мінеральних кислот. реакції електрофільного заміщення(SE). Будучи я-надлишковими ароматичними системами, пірол, фуран і тіофен легко вступають у характерні для ароматичних сполук реакції електрофільного заміщення. ці реакції перебігають значно легше, ніж у бензену. Зазначені гетероцикли за активністю в реакціях з електрофільними реагентами розташовуються в ряд: О О О н тіофен фуран пірол Активність гетероциклів у SE-реакціях П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи
Н
о-ко2 х ^°2 хон X = О; N11; 8 ацетилнітрат 2-нітрофуран (X = О); 2-нітропірол (X = N11); 2-нітрагіофен (X = 8) Сульфування. Для сульфування фурану і піролу (ацидофобні гетероцикли) як електрофільний реагент замість сульфатної кислоти використовують комплекс піридину із сульфур(VI) оксидом — піридинсульфотриоксид C5H5N • SO3. цей суль-фуючий реагент був запропонований російським хіміком Олександром Петровичем Терентьєвим 1947 року. Сульфування проходить по а-положенню з утворенням сульфокислот.
+ X = О; з піридин- 2-фурансульфокислота (X = О); піридин сульфотриоксид 2-піролсульфокислота (X = N11) Тіофен легко сульфується концентрованою сульфатною кислотою. Реакція проходить на холоді, майже з кількісним виходом. У цій реакції тіофен значно більш реакційноздатний, ніж бензен, який із сульфатною кислотою в зазначених умовах не реагує. цю реакцію використовують при очищенні технічного бензену від домішки тіофену. ^„> + Н28О4(конц.) —► ^СХСО„ + Н20 тіофен 2-тіофенсульфокислота Глава 32
Поиск по сайту: |



 32.3. П'ЯТИЧЛЕННІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ З ОДНИМ ГЕТЕРОАТОМОМ
32.3. П'ЯТИЧЛЕННІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ З ОДНИМ ГЕТЕРОАТОМОМ









 Використовують також метод перегонки сукциніміду з цинковим пилом: Н,С—СН,
Використовують також метод перегонки сукциніміду з цинковим пилом: Н,С—СН, -х -22пО
-х -22пО \} у-'ч —С02
\} у-'ч —С02

 Глава 32
Глава 32