|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
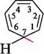
ЦИКЛОГЕПТАТРИЄНІЛ-КАТІОН
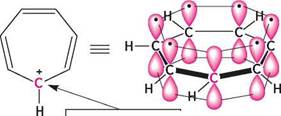
циклогептатриєніл-катіон (тропілій-катіон) утворюється при відщепленні гідрид-іона (атома Гідрогену з двома електронами) від метиленової групи неБенЗОЇДнІ арОматиЧнІ СПОЛУКи 1,3,5-циклогептатриєну (тропілідену). Так, при взаємодії 1,3,5-циклогептатриєну з бромом утворюється тропілій бромід, який містить циклогептатриєніл-катіон:
8+ 8-+ Вг-ИЗг Н Н Циклогептатриєн тропілій бромід Тропілій-катіон має ароматичність. У семичленній циклічній структурі тропілі-євого іона всі атоми Карбону перебувають у sp2-гібридизованому стані. Унаслідок перекривання шести одноелектронних p-орбіталей подвійних зв'язків і однієї вакантної p-орбіталі атома Карбону катіонного центру утворюється замкнена я-електронна хмара (ароматичний секстет), яка охоплює всі атоми Карбону циклу. При цьому позитивний заряд катіонного центру рівномірно розподіляється між сімома атомами Карбону (рис. 17.2).
Унаслідок ароматичності тропілій-катіон досить стійкий. Маючи дефіцит електронної густини, тропілій-катіон виявляє електрофільні властивості і легко вступає в реакції з нуклеофільними реагентами, утворюючи продукти приєднання, які призводять до порушення ароматичності:
+ осн, Метокси-1,3,5-циклогептатриєн АЗУЛЕН Азулен — біциклічна конденсована система, що складається з циклопентаді-єнового і циклогептатриєнового кілець: НС.6 2 СН азулен; біцикло[5.3.0]декапентаєн Глава 17 240 Г Молекула азулену має біполярну будову — атоми Карбону п'ятичленного циклу несуть частковий негативний, а семичленного — частковий позитивний заряд. Утворення біполярної структури зумовлено намаганням кожного кільця мати ароматичний секстет p-електронів. Така можливість з'являється при переході одного електрона із семичленного циклу в п'ятичленний, унаслідок чого п'ятичленне кільце набуває негативного заряду, а семичленне — позитивного.
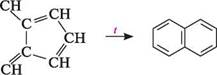
Тому азулен можна розглядати як конденсовану систему, що складається з циклопентадієніл-аніона і тропілій-катіона. Азулен має ароматичність. Ароматичний характер азулену виявляється в схильності до реакцій електрофільного заміщення (галогенування, нітрування, сульфування, ацилювання), які перебігають по п'ятичленному кільцю в положеннях 1 або 1 і 3. При нагріванні азулен ізомерується в нафтален:
азулен нафтален Алкілпохідні азулену містяться в ефірних оліях низки лікарських рослин (ромашки, деревію, полину, евкаліпта тощо). їх присутністю зумовлена протизапальна дія цих рослин. Глава 18 ГАЛОГЕНОПОХІДНІ ВУГЛЕВОДНІВ Галогенопохідними вуглеводнів називають продукти заміщення у вуглеводнях одного або кількох атомів Гідрогену атомами галогенів. Галогенопохідні вуглеводнів залежно від природи вуглеводневого радикала поділяють на аліфатичні, аліциклічні та ароматичні. У ряді аліфатичних галогенопохідних вуглеводнів розрізняють насичені (галогеналкани) і ненасичені (галогеналке-ни, галогеналкіни). Ароматичні галогенопохідні вуглеводнів поділяють на сполуки, в яких атом галогену безпосередньо зв'язаний з ароматичним ядром (галогенарени), і речовини, що містять атом галогену в боковому ланцюзі (арилалкілгалогеніди). Відповідно до природи атома галогену галогенопохідні вуглеводнів підрозділяють на флуоро-, хлоро-, бромо-, йодопохідні. За кількістю атомів галогену в молекулі розрізняють моно-, ди-, три- та полігалогенопохідні вуглеводні. НОМЕНКЛАТУРА За замісниковою номенклатурою ШРАС назви галогенопохідних вуглеводнів складають аналогічно назвам відповідних вуглеводнів. Атоми галогенів, які входять до їх складу, позначають у назві у вигляді префікса, до якого додають назву родоначальної структури. В аліфатичних галогенопохідних вуглеводнів за родоначальну структуру обирають головний вуглецевий ланцюг, в аліциклічних і ароматичних — цикл:
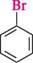
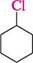
сн3— сн2— сн—сн3 2-бромобутан хлороциклогексан бромобензен якщо при родоначальній структурі є кілька замісників, якими, крім атомів галогенів, можуть бути і вуглеводневі радикали, то в назві їх перелічують за алфавітним порядком. Атоми Карбону родоначальної структури нумерують у цьому разі таким чином, щоб замісник, позначений у назві першим, отримав якомога менший номер: сн3— сн— сн2— сн—сн3 сн3— сн— сн2— сн— сн3 Вг СН3 СІ СН3 2-бром-4-метилпентан 2-метил-4-хлоропентан Глава 18
сн3—сн—сн—сн2—сн3 СН3 Вг сн3—сн—сн3
сн3—сн—сн3
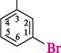
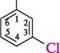
1 -ізопропіл-З-хлоробензен З-бром-2-метилпентан 1-бром-З-ізопропілбензен У галогеналкенах і галогеналкінах нумерацію атомів Карбону головного ланцюга здійснюють так, щоб якомога менші номери отримали атоми Карбону кратного зв'язку:
сн2— с= сн, СІ 5-бром-3-метип-1-пентен 3-хлоропропін Для найпростіших галогенопохідних вуглеводнів широко використовують радикало-функціональну номенклатуру, за якою назву складають з назви вуглеводневого радикала, зв'язаного з атомом галогену, і суфікса -флуорид, -хлорид, -бромід або -йодид: СН3— Р метилфлуорид С2Н5—Вг етилбромІд С6Н5—СН2—СІ бензилхлорид
н2с=сн—сн2— вінілхлорид алілйодид Повністю галогеновані вуглеводні (всі атоми Гідрогену заміщені атомами галогену) називають пергалогенованими (у назвах використовують префікс пер-):
С=С перфлуоретан перфлуоретилен За деякими галогеновуглеводнями збереглися тривіальні назви: СІ СН3С1 хлористий метил СНС13 СНВг3 СНІ3 Н2С=С—СН=СН2 хлороформ бромоформ йодоформ хлоропрен ІЗОМЕРІЯ Для галогенопохідних вуглеводнів характерні структурна, геометрична та оптична ізомерії. Структурна ізомерія обумовлена різною структурою вуглецевого скелета молекули і різним положенням атомів галогенів у ланцюзі. Так, хлоробутан C4H9Cl існує у вигляді чотирьох структурних ізомерів: ГаЛОГенОПОхІДнІ ВУГЛеВОДнІВ
СІ СІ 1-хлоробутан 2-хлоробутан сн3 сн3 сі С1 2-метил-1-хіюропропан 2-метил-2-хлоропропан Дигалогенопохідні можуть бути представлені кількома структурними ізомерами, які відрізняються взаємним розташуванням атомів галогенів: сн2—сн—сн3 сн2—сн2—сн2 сн3—сн2—сн сн3—с —сн3 СІ СІ СІ СІ С1 СІ 1,2-дихлоропропан 1,3-дихлоропропан 1,1-дихлоропропан 2,2-дихлоропропан Дигалогенопохідні вуглеводнів з атомами галогенів біля одного і того ж атома Карбону називають гемінальними (скорочено гем), біля сусідніх атомів Карбону — віцинальними (скороч. віц). /Вг сн,—сн—сн2 гем-дибромопропан вг'ч-дибромопропан Для галогеналкенів, які мають різні замісники при атомах Карбону, що утворюють подвійний зв'язок, поряд зі структурною ізомерією можлива геометрична ізомерія:
Н Н \ / /с=с\ а сн3 ще-1 -хлоропропен транс-1 -хлоропропен Для галогеналканів, що містять у своїй структурі асиметричний атом Карбону, характерна оптична ізомерія (див. розд. 5.2.2). Так, 2-хлоробутан CH3CH2C*HClCH3 існує у вигляді двох дзеркальних ізомерів (енантіомерів):
Глава 18 244 Г ГАЛОГЕНАЛКАНИ СПОСОБИ ДОБУВАННЯ Галогенування алканів.Взаємодія алканів з галогенами здійснюється при УФ-опромінюванні за вільнорадикальним механізмом SR (див. с. 133). Метод дозволяє одержати хлор- і бромалкани. Вадою цього способу є утворення суміші моно-, ди- і полігалогеналканів: сн4Щ£*» сн3сі Щ£+ сн2сі2 Щ£+ снсі3Щ£+ ссі4 хпорометан дихлорометан трихлорометан; тетрахлорометан хлороформ Приєднання галогеноводнів до алкенів(див. с. 147). , + НВг —► СН,— СН— ЄН, Вг пропен 2-бромопропан Метод дозволяє одержати флуор-, хлор-, бром- і йодалкани. Добування зі спиртів.Для одержання галогеналканів зі спиртів як галогенуючі реагенти використовують галогеноводні (HCl, HBr, HI), галогеніди фосфору (PCl3, PCl5, PBr3, PBr5) і тіонілхлорид SOCl2. Взаємодія спиртів з галогеноводнями відбувається за такою схемою: С2Н5—ОН+ НВг—► С2Н5—Вг + Н2О етанол брометан Зазвичай галогеноводні виділяються безпосередньо в процесі взаємодії солей галогеноводневих кислот з концентрованою сульфатною кислотою: С2Н5—ОН+ КВг+ Н28О4—► С2Н5—Вг+ КН8О4+ Н2О За допомогою цієї реакції можна одержати хлор-, бром- та йодалкани. Особливості перебігу реакції залежно від будови спирту і природи галогеноводню, а також механізм взаємодії розглянуто в розд. 22.1.5. З більш високими виходами галогеналкани утворюються при взаємодії спиртів з фосфор(III) або фосфор(V) галогенідами, а також з тіонілхлоридом SOCl2: зс2н5—он + рсі3 —► зс2н5—сі + н3ро3 с2н5—он + рсі5 —► с2н5—сі + неї + росі3 С2Н5—ОН + 8ОС12 —► С2Н5—СІ + НС1І + 8О2І Реакція з тіонілхлоридом найзручніша, тому що всі побічні продукти є газоподібними речовинами і легко виходять з реакційного середовища. Взаємодія галогеналканів із солями галогеноводневих кислот (реакція Фінкель-штейна).При дії на хлор- або бромалкани натрій йодиду в середовищі ацетону відбувається заміщення атома Хлору або Брому на атом йоду: ацетон С2Н5—Вг+ №1 ► С2Н5—І + ИаВг Реакцію використовують для одержання йодалканів з більш доступних хлоро-або бромопохідних вуглеводнів. ГаЛОГенОПОхІДнІ ВУГЛеВОДнІВ ФІЗИЧНІ ВЛАСТИВОСТІ За звичайних умов нижчі галогеналкани — безбарвні гази або рідини зі своєрідним солодкуватим запахом, середні — рідини, вищі — тверді речовини (табл. 18.1). Таблиця 18.1 Фізичні характеристики галогеналканів
Температура кипіння зростає зі збільшенням атомної маси галогену, кількості атомів галогену (за винятком флуоропохідних) і довжини вуглецевого ланцюга молекули. Нижчі галогеналкани практично нерозчинні у воді, але легко розчиняються в органічних розчинниках. Деякі з них є ефективними розчинниками. Багато галогеналканів мають наркотичну дію. ХІМІЧНІ ВЛАСТИВОСТІ Галогеналкани — досить реакційноздатні речовини. Найбільш характерні для них реакції нуклеофільного заміщення (SN) і відщеплення (E). Вони також здатні до взаємодії з металами і відновлення. РЕАКЦІЇ НУКЛЕОФІЛЬНОГО ЗАМІЩЕННЯ (SN) Галогеналкани є електрофільними реагентами. їх електрофільні властивості зумовлені полярністю зв'язку C—Hal. Оскільки атом галогену виявляє більшу електронегативність, ніж атом Карбону, електронна густина зв'язку C—Hal у галогеналканів зміщена до атома галогену. У результаті атом галогену набуває часткового негативного (5-), а атом Карбону — часткового позитивного (5+) заряду 8+ 8- (С 9al). електронодефіцитний атом Карбону стає електрофільним центром молекули галогеналкану і може бути атакований нуклеофільним реагентом. У процесі атаки нуклеофіл надає пару електронів для утворення хімічного зв'язку з елек- Глава 18 246Г тронодефіцитним атомом Карбону, а атом галогену відщеплюється від молекули галогеналкану з електронною парою зв'язку C—Hal:
Таку реакцію називають реакцією нуклеофільного заміщення і позначають символом SN. Нуклеофільними реагентами можуть бути речовини, які містять у мо-лекулах атоми з неподіленими парами електронів (H3, R—H2, R2H, HH тощо), або речовини, що утворюють при дисоціації аніони (нуклеофільні частинки): ШОН (ОН ), С2Н5ОКа (С2Н5О ), КСК (СІчГ), Ка8Н (8Н ), КаІчГО2 (ІЧО2), CH3COONa (СН3СОО ), KBr (Вг), KI (І) тощо. У результаті нуклеофільного заміщення в структуру нуклеофілу вводиться ал-кільний замісник, тобто відбувається алкілювання нуклеофілу. Тому галогеналкани є алкілюючими реагентами. Схильність галогеналканів до реакцій SN визначається полярністю зв'язку С—Hal (статичний фактор). Виходячи з величин електронегативностей атомів галогенів (див. с. 47), полярність зв'язку C—Hal збільшується в ряду: С—I < C—Br < < C—Cl < C—F. Отже, можна припустити, що флуоропохідні галогеналканів мають бути більш реакційноздатні, ніж хлоропохідні, а останні — більш активними, ніж бромо- і йодопохідні. Реально ж реакційна здатність галогеналканів у реакціях SN зменшується в ряду: К—I > К—Вг > К—СІ » К—Р реакційна здатність галогеналканів у SN-реакціях
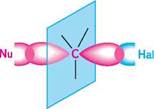
К—І > К—Вг > К—СІ Залежно від будови галогеналкану, природи нуклеофілу і розчинника реакції нуклеофільного заміщення перебігають за двома основними механізмами: механізмом SN2 і механізмом SN1. механізм SN2 (бімолекулярне нуклеофільне заміщення).За механізмом 8^ реакція відбувається в одну стадію через утворення перехідного стану, у побудові якого бере участь як молекула галогеналкану, так і нуклеофільний реагент. У механізмі SN2 нуклеофіл атакує електрофільний центр молекули галогеналкану (атом Карбону, зв'язаний з атомом галогену) з боку, протилежного зв'язку С—Hal (атака з тилу). При зближенні нуклеофілу з галогеналканом у їх молекулах відбувається перерозподіл електронної густини хімічних зв'язків. У результаті ГаЛОГенОПОхІДнІ ВУГЛеВОДнІВ утворюється перехідний стан як украй нестійке сполучення двох реагентів, в якому зв'язок C—Hal послаблюється і починає формуватися зв'язок C—Nu. Перехідний стан перебуває в рівновазі з вихідними реагентами. йому відповідає максимум на енергетичній діаграмі реакції. У міру подальшого зближення реагентів у перехідному стані відбувається синхронний процес розриву зв'язку C—Hal і утворення зв'язку C—Nu: N11 N11 —С—Наї / 1-Сч* Наї" Перехідний стан
З позицій теорії МО при утворенні перехідного стану відбувається перегібридизація центрального атома Карбону, а саме: вихідна sp3-гібридизація змінюється на sp2-гібридизацію. Унаслідок цього три нереагуючі зв'язки атома Карбону розташовуються в одній площині, перпендикулярно якій знаходиться негібридизована p-орбіталь. Одна частина цієї p-орбіталі частково перекривається з орбіталлю атакуючого нуклеофілу, а друга—з орбіталлю атома галогену (рис. 18.1). якщо електрофільним центром у молекулі галоген-алкану є асиметричний атом Карбону, то нуклеофільне заміщення атома галогену супроводжується оберненням конфігурації. це підтверджує, що в механізмі SN2 нуклеофільна атака електрофіль-ного центру галогеналкану здійснюється з тилу (фронтально): сн3
8- 8-
н* ан 2'5 А Ізомер Д-ізомер За пропозицією англійського хіміка К. Інгольда описаний механізм одержав позначення SN2. Буква S указує на заміщення, N — на нуклеофільний тип реакції, а цифра 2 позначає, що реакція є бімолекулярною, тобто в стадії, яка визначає швидкість реакції в цілому (у цьому випадку утворення перехідного стану), беруть участь два реагенти (галогеналкан і нуклеофіл). швидкість реакцій, які перебігають за механізмом SN2, залежить від концентрації обох реагентів і описується кінетичним рівнянням другого порядку v = k[R—Hal] [Nu]. Чинники, які сприяють перебігу реакцій за механізмом SN2. Реакційна здатність галогеналканів за механізмом SN2 тим вища, чим більший частковий позитивний заряд на атомі Карбону, зв'язаному з атомом галогену. Тому серед первинних галогеналканів активність підвищується в ряду:
'+ 5+ -Вг Глава 18 248 Г Однак поряд з електронними факторами значно більше впливають на реакційну здатність галогеналканів за механізмом SN2 просторові чинники. Чим більші кількість і об'єм замісників при атомі Карбону, зв'язаному з атомом галогену, тим важче утворюється перехідний стан через просторові перешкоди. У зв'язку з цим за механізмом SN2 легко реагують первинні і дещо важче — вторинні галогеналкани. Третинні галогеналкани через просторові перешкоди в реакції нуклеофільного заміщення за механізмом SN2 не вступають. Для реакцій, які перебігають за механізмом SN2, важливе значення має природа нуклеофілу, тому що він бере участь в утворенні перехідного стану. Чим вища реакційна здатність нуклеофілу, тим легше проходить реакція за механізмом Під нуклеофільністю (нуклеофільною силою) реагенту розуміють його здатність утворювати за рахунок неподіленої пари електронів ковалентний зв'язок з елек-тронодефіцитним атомом Карбону. Нуклеофільність реагенту залежить від низки чинників: електронегативності і поляризованості нуклеофільного центру (атома з неподіленою парою електронів, або негативним зарядом), характеру замісників, зв 'язаних з нуклеофільним центром, і розчинника. При рівних інших факторах зі збільшенням електронегативності атома нуклеофільного центру в межах одного і того ж періоду Періодичної системи елементів Д. І. Менделєєва неподілені пари електронів утримуються міцніше і, отже, нуклеофільність реагенту зменшується. Так, нуклеофільність таких сполук і відповідних їм аніонів знижується в рядах: 3 > Н2О > НР ~ > ОН > Р нуклеофільність
ІЧН^ > ІЧН3; ОН > Н2О; 8Н > Н28 У межах групи Періодичної системи елементів нуклеофільність збільшується згори вниз відповідно до зростання поляризованості нуклеофільного центру. Так, нуклеофільність галогенід-іонів збільшується в ряду: ,1
Вг \/ Ті- Аналогічно нуклеофільність сульфуровмісних нуклеофілів вища, ніж в оксигено-вмісних аналогів: К8 > КО ; 8Н > ОН
Поиск по сайту: |
 5/з2-гібридизований атом Карбону
5/з2-гібридизований атом Карбону Рис. 17.2. Схема утворення ароматичної системи циклогептатриєніл-катіона
Рис. 17.2. Схема утворення ароматичної системи циклогептатриєніл-катіона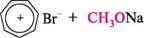
 тропілій бромід
тропілій бромід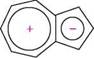
 сн3— сн2— сн2— сн2 сн3— сн2— сн—сн3
сн3— сн2— сн2— сн2 сн3— сн2— сн—сн3
 Закономірність, що спостерігається, пояснюється поляризованістю зв'язку С—Hal, тобто здатністю зв'язку збільшувати полярність при підході нуклеофільного реагенту (динамічний фактор). як відомо, поляризованість зв'язку тим більша, чим більш об'ємиста і рухлива електронна оболонка атомів, які утворюють зв'язок. Серед галогенів найвищу поляризованість має атом йоду, найменшу — атом Флуо-ру, а тому зв'язок C—I більш схильний до гетеролітичного розриву, ніж зв'язок С—F. Через низьку поляризованість зв'язку C—F флуоралкани практично не вступають у реакцію нуклеофільного заміщення. Активність інших галогеналканів відносно нуклеофілів знижується в ряду:
Закономірність, що спостерігається, пояснюється поляризованістю зв'язку С—Hal, тобто здатністю зв'язку збільшувати полярність при підході нуклеофільного реагенту (динамічний фактор). як відомо, поляризованість зв'язку тим більша, чим більш об'ємиста і рухлива електронна оболонка атомів, які утворюють зв'язок. Серед галогенів найвищу поляризованість має атом йоду, найменшу — атом Флуо-ру, а тому зв'язок C—I більш схильний до гетеролітичного розриву, ніж зв'язок С—F. Через низьку поляризованість зв'язку C—F флуоралкани практично не вступають у реакцію нуклеофільного заміщення. Активність інших галогеналканів відносно нуклеофілів знижується в ряду: