|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
АРОМАТИЧНІ НІТРОСПОЛУКИ
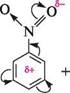
СПОСОБИ ДОБУВАННЯ нітрування аренів.Нітросполуки, що містять нітрогрупу, зв'язану з ароматичним радикалом, одержують нітруванням аренів сумішшю концентрованих нітратної і сульфатної кислот (див. с. 200):
N0,
Н,8О4 (конц.) + ЖЖОЛконц.)—ї—іі------ '-*- + Н,0 нітробензен Глава 19 Для введення другої нітрогрупи потрібні більш жорсткі умови: висока температура, концентровані кислоти, тривале нагрівання. Уведення третьої нітрогрупи в молекулу бензену відбувається надзвичайно важко при надлишку димучої нітратної і сульфатної кислот:
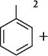
НЖ>3(конц.); Н28О4 (конц.); 1 -Н2О N0, N0, N0, 1,3 - динітробензен 1,3,5 -тринітробензен При наявності в ядрі електронодонорних замісників реакція нітрування значно полегшується. Так, при нітруванні толу ену можна в звичайних умовах увести три нітрогрупи за схемою:
4-нітротолуен 2,4 -динітротолуен Для одержання ароматичних нітросполук з нітрогрупою в боковому ланцюзі застосовують способи добування, аналогічні методам синтезу нітроалканів: нітрування гомологів бензену за умов реакції Коновалова (див. с. 136); взаємодія арилалкілгалогенідів із солями нітритної кислоти (див. с. 252) і т. д. ФІЗИЧНІ ВЛАСТИВОСТІ Нітроарени, що містять у своєму складі одну нітрогрупу, є рідинами або кристалічними речовинами. Вони безбарвні або забарвлені в блідо-жовтий колір, нерозчинні у воді. Рідкі нітросполуки важчі за воду. Нітроарени мають запах гіркого мигдалю. це полярні речовини, що мають високі температури плавлення. Нітроарени, які містять кілька нітрогруп (полінітросполуки),— кристалічні речовини, забарвлені в жовтий колір. Вибухові. ХІМІЧНІ ВЛАСТИВОСТІ Відновлення нітроаренів (реакція Зініна). При відновленні ароматичних нітросполук утворюються ароматичні аміни. Уперше реакцію відновлення нітробензену в анілін здійснив 1842 року відомий російський учений Микола Миколайович Зінін. як відновники найчастіше використовують Fe, Sn або Zn у хлоридній кислоті, амоній сульфід (NН4)2S, натрій гідросульфід NaHS, гідразин H2N—NH2 у присутності нікелю Ренея. НІтрОСПОЛУКи Залежно від рН реакційного середовища процес відновлення може проходити у двох напрямах, які відрізняються утворенням різних проміжних сполук. У нейтральному і кислому середовищах як проміжні сполуки утворюються ароматичні нітрозосполуки та арилгідроксиламіни:
При відновленні в нейтральному середовищі реакцію можна зупинити на будь-якій стадії. У кислому середовищі виділити проміжні продукти неможливо. У лужному середовищі відбувається конденсація проміжних продуктів відновлення — нітрозосполук з арилгідроксиламіном. це приводить до появи азокси-сполук, що відновлюються до азосполук. Останні, приєднуючи водень, перетворюються в гідразосполуки, які, у свою чергу, легко перетворюються в ариламіни:
нітрозобензен 2Н азобензен Н н гідразобензен анілін Реакцію відновлення нітроаренів у лужному середовищі можна зупинити на кожній із наведених стадій. Вона слугує основним способом добування азо-і гідразосполук. РЕАКЦІЇ ПО АРОМАТИЧНОМУ ЯДРУ реакції електрофільного заміщення(SE). Нітрогрупа, маючи електроноакцептор-ний вплив (—I-, —М-ефект), дезактивує бензенове ядро в реакціях електрофільного заміщення. Так, нітробензен не алкілюється в умовах реакції Фріделя—Крафтса:
СН3С1 Тому часто нітробензен у цих реакціях використовується як розчинник. Однак він може вступати в реакції нітрувания, галогенування, сульфування з утворенням відповідних мета-заміщених продуктів: Глава 19
Поиск по сайту: |



 N0,
N0,



 СН,
СН,

 нітробензен
нітробензен