 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
НОМЕНКЛАТУРА. ІЗОМЕРІЯ. За замісниковою номенклатурою назви нітроалканів і нітросполук з нітрогрупою в
За замісниковою номенклатурою назви нітроалканів і нітросполук з нітрогрупою в бензеновому кільці утворюють додаванням префікса нітро- до назви родоначального вуглеводню з указівкою положення нітрогрупи у вуглецевому ланцюзі: Глава 19
сн3— сн— сн2— сн3 сн3— сн— сн— сн3 N0, N0, N0., 2-нітробутан 2-метил-З-нітробутан нітробензен 3-нітротолуен Нітросполуки з нітрогрупою в боковому ланцюзі розглядають як похідні нітро-алканів, що містять як замісник ароматичний радикал:
СН2-СН2-НО2 фенілнітрометан 1-нітро-2-фенілетан Ізомерія нітросполук може бути зумовлена різною структурою вуглецевого скелета (ізомерія ланцюга) і різним положенням нітрогрупи у вуглецевому ланцюзі (ізомерія положення):
Ізомери положення
Т Т Т7 СН3— СН2— СН2— СН2—N0;; СН3— СН — СН2— СН3 N0;;
2-нітробутан
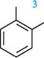
2-нітротолуен
N0, 3-нітротолуен СН,
4-нітротолуен НІТРОАЛКАНИ СПОСОБИ ДОБУВАННЯ нітрування алканів (реакція Коновалова). Реакція перебігає при дії на алкани розведеною нітратною кислотою (10—25%-вою) при підвищених температурі і тиску (див. с. 136):
СН3—СН2—СН3 Взаємодія галогеналканів із солями нітритної кислоти.цей метод дозволяє одержати первинні і вторинні нітроалкани (див. с. 252). Для зменшення домішок нІтрОСПОЛУКи -------------------------------------------------------------------------------------------------------------------------- 271 естерів нітритної кислоти, які утворюються в процесі реакції, взаємодію первинних і вторинних галогеналканів із солями нітритної кислоти (AgNО2, NаNО2, КNО2) здійснюють у середовищі апротонного розчинника — диметилсульфоксиду (СН3)2SO або диметилформаміду HCON(CH3)2: г< хт т + \гя\гп >- С її МО + ХГяТ ^2-П-^ А -^ <*-^ 2 2 5 2 Окиснення трет-алкіламінів. цим способом одержують тільки третинні нітросполуки. Первинні аміни, що містять трет-алкільний вуглеводневий залишок, у присутності органічних пероксикислот окиснюються, утворюючи нітроалкани: сн3 сн3 сн3—с—сн3 -£^*- сн3— с—сн3 МН2 N02 2-метил-2-пропанамін 2-метил-2-нітропропан Зазвичай нітроалкани — безбарвні або ледь жовтуваті рідини з приємним запахом, отруйні. Вони малорозчинні у воді, розчинні в більшості органічних розчинників. це полярні сполуки, для яких характерні великі дипольні моменти (3,15—3,7 Db). Температури кипіння нітроалканів вищі, ніж відповідних спиртів або карбонільних сполук. ХІМІЧНІ ВЛАСТИВОСТІ Реакційна здатність нітроалканів визначається наявністю в їх структурі нітро-групи. Завдяки сильним електроноакцепторним властивостям нітрогрупа активує атоми Гідрогену при а-атомі Карбону вуглеводневого радикала сн3— сн2— сн—п{ !5+ о н Тому первинні і вторинні нітроалкани є СН-кислотами. Хімічні перетворення нітроалканів відбуваються за участі нітрогрупи та а-атома Карбону. таутомерія та утворення солей. Первинні і вторинні нітроалкани є таутомер-ними сполуками, в яких нітроформа (нітроалкан) знаходиться в рухомій рівновазі з аци-нітроформою (нітроновою кислотою): к— сн —ії? ^=^ к— сн = т^ нітроформа аци -нітроформа Така таутомерія одержала назву «аци-нітротаутомерія». У нейтральному середовищі рівновага зазвичай майже повністю зміщена убік нітроформи. Перетворення нітроформи в аци-нітроформу проходить через стадію утворення амбідентного (двоїстого) аніона, стабілізованого за рахунок кон'югації: Глава 19
К—СН—N Н О О -нт К—СН—N К—СН= к—сн= ,о—н
Ч
Г
К
Ч К натрієва сіль нітронової кислоти Н20 Солі нітронових кислот вибухонебезпечні. якщо лужний розчин нітроалкана обробити мінеральною кислотою, спочатку утворюється розчинна у воді нестійка нітронова кислота, яка потім перетворюється в нерозчинний у воді нітроалкан: /=Тчї
натрієва сіль нітронової кислоти к' чо нітронова кислота \ нітроалкан Ч о Третинні нітроалкани не мають атомів Гідрогену при а-атомі Карбону, а отже, для них не характерна аци-нітротаутомерія, і тому вони не розчиняються у водних розчинах лугів. реакція з нітритною кислотою.Взаємодія нітроалканів з нітритною кислотою відбувається за участі рухливих атомів Гідрогену при а-атомі Карбону. Первинні нітроалкани реагують з нітритною кислотою з утворенням алкілнітро-лових кислот. Реакція проходить через стадію утворення нітрозонітросполуки: К—С—N0, Н н первинний нітроалкан + НО—N=0 К—С— N0. #N= нітрозонітро-сполука К—С—N02 И—он алкілнітролова кислота
кч к — N0,, + НО—N=0 вторинний нітроалкан ; К і N=0 псевдонітрол н2о нІтрОСПОЛУКи -------------------------------------------------------------------------------------------------------------------------- 273 Розчини і розплави псевдонітролів забарвлені в синій колір. Третинні нітросполуки з нітритною кислотою не реагують. Первинні, вторинні та третинні нітросполуки можна відрізнити одна від одної реакцією з нітритною кислотою. реакція з альдегідами і кетонами.Первинні і вторинні нітроалкани в слабколуж-ному середовищі вступають у реакцію конденсації з альдегідами і кетонами, утворюючи нітроалканоли. ця реакція проходить за типом альдольної конденсації.
При конденсації первинних нітроалканів з карбонільними сполуками нітро-алканоли, які утворюються, здебільшого відщеплюють молекулу води, і реакція завершується утворенням ненасичених нітросполук: ОН о^ І я—сн2 + ^;с—сн3—*■ я—сн—сн—сн3 т^^я—с=сн— сн3 н З формальдегідом первинні нітроалкани часто утворюють продукти конденсації з двома, а нітрометан — із трьома молекулами альдегіду: н_с^° СН2ОН н_с^° СН2ОН я—сн2 -------- ^ я—сн ----------- ^* я—с—сн2он Відновлення нітроалканів.При відновленні нітроалканів утворюються алкан-аміни: С2Н5—N02 + 6Н *► С2Н5~ КН2 + 2Н2° як відновники використовують станум(II) хлорид, ферум у присутності хло-ридної кислоти, сульфіди лужних металів тощо.
Поиск по сайту: |



 СН2-М)2
СН2-М)2

 ізомери положення
ізомери положення
 сн
сн
