 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
БаГатОяДернІ арени З ІЗОЛЬОВаними БенЗенОВими ЦиКЛами
До амінопохідних трифенілметану належать також барвники — малахітовий зелений і кристалічний фіолетовий:
Й(СН3)2
с\
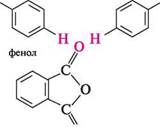
Й(СН3)2 СІ К(СН3)2 кристалічний фіолетовий Малахітовий зелений використовують для фарбування тканин (бавовни, вовни, шовку) у зелений колір, а кристалічний фіолетовий — переважно як кислотно-основний індикатор для титрування у водних і неводних середовищах. У водному середовищі він має два переходи забарвлення: в інтервалах pН = 0...1,0 жовте забарвлення переходить у зелене, а при pН = 1,0...2,6 — зелене переходить у фіолетове. Представником гідроксипохідних трифенілметану є фенолфталеїн. Одержують його конденсацією фенолу з фталевим ангідридом у присутності концентрованої сульфатної кислоти. Унаслідок реакції утворюється безбарвна (лактонна) форма фенолфталеїну:
О фталевий ангідрид ОН Н28О4 (конц.); 130 °С
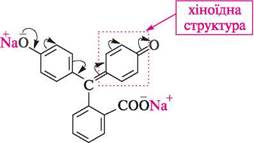
ОН фенолфталеїн (безбарвна форма) Фенолфталеїн — біла кристалічна речовина (т. пл. 259—263°С), практично нерозчинний у воді, добре розчиняється в етанолі. Фенолфталеїн використовують Глава 16 в аналітичній практиці як кислотно-основний індикатор. У кислому і нейтральному середовищах він перебуває в безбарвній лактонній формі, у лужному середовищі (при pН = 8,2... 10,0) набуває малиново-червоного забарвлення внаслідок утворення хіноїдної структури:
НО ОН 2НС1
фенолфталеїн (безбарвна форма) фенолфталеїн (форма з малиново-червоним забарвленням) У сильнолужному середовищі (рН > 12) малиново-червоне забарвлення фенолфталеїну зникає внаслідок утворення солі бензоїдної структури:
фенолфталеїн (форма з малиново-червоним забарвленням) безбарвна форма Фенолфталеїн використовують у медицині як проносний засіб при хронічних запорах (пурген). Глава 17 НЕБЕНЗОЇДНІ АРОМАТИЧНІ СПОЛУКИ як уже зазначалося, критерієм ароматичності сполуки є наявність у її структурі плоского циклу, що має замкнену кон'юговану систему, яка містить (4n+2) я-електронів. цим вимогам задовольняє ряд сполук, які не містять у своєму складі бензенових циклів. Найважливішими представниками небензоїдних ароматичних систем є циклопентадієніл-аніон, циклогептатриєніл-катіон (тропілій-катіон) та біциклічний вуглеводень азулен.
ЦИКЛОПЕНТАДІЄНІЛАНІОН При взаємодії 1,3-циклопентадієну з металічним натрієм у киплячому ксилені активна метиленова група відщеплює протон, утворюючи циклопентадієнілнатрій, який містить ароматичний циклопентадієніл-аніон:
не—сн // \\ НС _ СН Н циклопентадієнілнатрій У циклопентадієніл-аніоні всі п'ять атомів Карбону знаходяться в sp2 -гібридизації. На п'ятьох р-орбіталях розміщаються шість p-електронів (чотири електрони двох я-зв'язків і два електрони аніонного центру) (рис. 17.1). Унаслідок перекривання p-орбіталей утворюється замкнена я-електронна хмара, яка має ароматичний секстет електронів. При цьому негативний заряд аніонного центру рівномірно розподіляється поміж п'ятьма атомами Карбону. Ароматичні властивості циклопентадієніл-аніона підтверджуються його здатністю вступати в реакції електрофільного заміщення (сульфування, азосполучен-ня), а також утворювати стійкі я-комплекси з катіонами двовалентних металів Глава 17
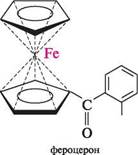
групи Феруму (Ферум, Кобальт, Нікол). При взаємодії циклопентадієнілнатрію із солями Феруму(II) утворюється фероцен (дициклопентадієнілферум):
вигляд зверху фероцен Фероцен — представник групи металорганічних сполук, які отримали загальну назву «металоцени». Методом рентгеноструктурного аналізу встановлено, що циклопентадієніль-ні аніони у фероцені розміщені один над одним у двох паралельних площинах, між якими розташований атом Феруму. Така будова, яка нагадує намазане масло між двома скибками хліба в бутерброді, отримала назву «сендвічевої структури» (від англ. sandwich — бутерброд).
Фероцен — типова ароматична сполука. Він стійкий до нагрівання і каталітичного гідрування, вступає в реакції електрофільного заміщення — алкілювання та ацилювання за Фріделем—Крафтсом, сульфування. У техніці фероцен використовують як антидетонатор і термічно стійкий теплоносій. Похідна фероцену — фероцерон — застосовується в медицині для лікування залізодефіцитних анемій.
Поиск по сайту: |


 НО
НО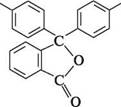


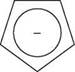
 5/з2-гібридизований атом Карбону
5/з2-гібридизований атом Карбону Рис. 17.1. Схема утворення ароматичної системи циклопентадієніл-аніона
Рис. 17.1. Схема утворення ароматичної системи циклопентадієніл-аніона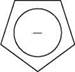
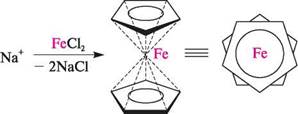
 Молекула фероцену — це я-комплекс, який утворюється внаслідок перекривання зв'язуючих я-МО двох циклопентадієніл-аніонів з вакантними АО катіона Феруму.
Молекула фероцену — це я-комплекс, який утворюється внаслідок перекривання зв'язуючих я-МО двох циклопентадієніл-аніонів з вакантними АО катіона Феруму.