 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
БУДОВА. ХІМІЧНІ ВЛАСТИВОСТІ
Молекула антрацену плоска. Усі атоми Карбону знаходяться в sp2-гібридизації. Кількість я-електронів (14 електронів) підпорядковується правилу ароматичності Гюккеля. Разом з тим електронна густина в молекулі антрацену розподілена ще нерівномірніше, ніж у нафталені. енергія резонансу антрацену (351,5 кДж/моль) значно менша потроєної енергії резонансу бензену (3-150,5 = 451,5 кДж/моль). Тому антрацен має менш виражену ароматичність, ніж нафтален, і значно меншу за бензен. Антрацен порівняно з нафталеном у більшій мірі схильний до реакцій приєднання та окиснення. Реакції електрофільного заміщення для антрацену проходять легко, але здебільшого вони супроводжуються утворенням проміжних продуктів приєднання, які можна виділити в індивідуальному вигляді. Найбільш реакційноздатними в антрацені є мезо-положення (положення 9 і 10). Антрацен легко відновлюється воднем у момент виділення й окиснюється концентрованою нітратною кислотою з утворенням відповідно 9,10-дигідроантрацену і 9,10-антрахінону: Глава 15
9,10-дигідроантрацен 9,10-антрахінон Реакції електрофільного заміщення, зокрема галогенування і нітрування, перебігають в положенні 9. При взаємодії з хлором або бромом спочатку утворюються продукти приєднання в положеннях 9 і 10, які при нагріванні відщеплюють гало-геноводень, перетворюючись у 9-галогенантрацени:
Вг,
ІШО3 (СН3СООН)
9-нітроантрацен У результаті сульфування антрацену сульфатною кислотою при нагріванні утворюється суміш 1-і 2-антраценсульфокислот, які є більш стійкими ізомерами, ніж 9-антраценсульфокислота.
8О3Н
Н28О4;
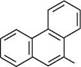
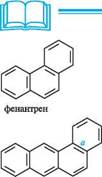
1-атраценсульфокислота 2-атраценсульфокислота Антрацен використовується переважно у виробництві антрахінону і барвників. ФЕНАНТРЕН Фенантрен — структурний ізомер антрацену. його молекула складається з трьох конденсованих ангулярно бензенових циклів. Структурну формулу фенан-трену подають двояко:
Нумерацію атомів Карбону в молекулі фенантрену здійснюють, як показано на структурній формулі. БаГатОяДернІ арени З КОнДенСОВаними БенЗенОВими ЦиКЛами Добувають фенантрен здебільшого з антраценової фракції кам'яновугільної смоли. Відомі також синтетичні методи добування фенантрену та його гомологів. За фізичними властивостями фенантрен безбарвна кристалічна речовина (т. пл. 101 °С), нерозчинний у воді, легко розчиняється в органічних розчинниках. Бензенові розчини фенантрену мають блакитну флуоресценцію. За будовою і реакційною здатністю фенантрен дуже схожий з антраценом. як і антрацен, він ароматична сполука, однак ароматичний характер фенантрену виражений дещо сильніше. Так, енергія резонансу фенантрену (387 кДж/моль) на 35,5 кДж/моль вища, ніж антрацену. Фенантрен так само, як і антрацен, легко вступає в реакції електрофільного заміщення, відновлення та окиснення. Найбільш активними є положення 9 і 10. Хімічний зв'язок між С-9 і С-10 у фенантрені надто нагадує подвійний, тому при електрофільному заміщенні в окремих випадках утворюються проміжні продукти приєднання, які можна виділити в індивідуальному вигляді:
-НВг Вг 9-бромофенантрен 9,10-дибром-9,10-дигідрофенантрен При нітруванні фенантрену нітратною кислотою в середовищі оцтової кислоти утворюється 9-нітрофенантрен. Каталітичне гідрування фенантрену призводить до утворення 9,10-дигідрофе-нантрену, при окиснюванні утворюється 9,10-фенантренхінон:
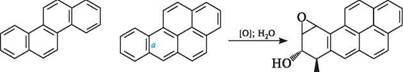
бензо[а]антрацен Промутагени У ряду конденсованих аренів виявлена численна група промутагенів, тобто речовин, що здобувають мутагенну активність, коли піддаються метаболізму в живому організмі. Високий їх вміст у кам'яновугільній смолі, автомобільних вихлопних газах, тютюновому димі тощо. У 1933 році здійснений синтез одного з найбільш небезпечних канцерогенів — бензо[a]пірену. Потрапляючи в організм, ця сполука піддається ферментативному розщепленню з утворенням бензо[a]пірен дигідроксиепоксиду.
Наявність у структурі продукту окиснення високореакційного тричленного циклу з атомом Оксигену (див. Оксиран, с. 543) визначає взаємодію з основами, які входять до складу ДНК. як наслідок, відбуваються серйозні порушення процесу поділу клітин і генетичного коду організму. Глава 15
2Н (СиО/Сг2О3)
[О]; СЮ3
9,10-фенантренхінон Сам фенантрен не знайшов значного практичного використання. Однак його частково або повністю гідровані похідні входять до складу багатьох природних сполук, які мають фізіологічну активність,— стероїдів (див. розд. 37.3.2), алкалоїдів (див. розд. 33.6) тощо. Так, в основі стероїдів покладено скелет стерану, який є конденсованою системою, що складається з повністю гідрованого фенантрено-вого ядра (пергідрофенантрену) і циклопентану:
стеран; циклопентанпергідрофенантрен Глава 16
До багатоядерних аренів з ізольованими циклами належать вуглеводні, які містять два або більше бензенових цикли, сполучених між собою або о-зв'язком, або через аліфатичний вуглецевий ланцюг. Найважливішими представниками цієї групи сполук є біфеніл, дифенілметан і трифенілметан. БІФЕНІЛ Молекула біфенілу містить два бензенових кільця, сполучених с-зв'язком. Для позначення положення замісників у молекулі біфенілу використовують цифрові локанти і позначення о-(орто-), м-(мета-) і п-(пара-) відповідно. Атоми Карбону кожного бензенового кільця нумерують окремо, починаючи з атома Карбону, через який здійснюється зв'язок із іншим циклом:
біфеніл 4,4'-диметилбіфеніл; п,Н -диметилбіфеніл Наявність замісників у положеннях 2,6,2',6' часто позначають у назві як орто-, у положеннях 3,5,3',5' — мета-, у 4,4' — пара-. СПОСОБИ ДОБУВАННЯ У невеликій кількості біфеніл міститься в кам 'яновугільній смолі. В промисловості застосовують кілька синтетичних способів добування біфенілу. Дегідрування бензену:
750-800 °С
-Н2 нагрівання йодобензену в присутності порошку міді (реакція Ульмана):
2Си; 200-250 °С -2СиІ 16.1.2.БУДОВА. ХІМІЧНІ ВЛАСТИВОСТІ Два бензенових кільця в молекулі біфенілу сполучені між собою с-зв'язком, довжина якого (0,148 нм) трохи менша від довжини вуглець-вуглецевого зв'язку в алканах (0,154 нм). Зменшення довжини с-зв'язку зумовлене мезомерною взає- Глава 16 модією я-електронів бензенових кілець, яка, як відомо, найефективніша при планарному розміщенні циклів.
За даними електронографічних досліджень у газовій фазі бензенові кільця біфенілу розташовані під кутом 45° один до одного. Отже, навколо с-зв'язку в молекулі біфенілу можливе вільне обертання. При відсутності в орто-положеннях замісників бар'єр обертання невеликий. Але якщо в орто-положеннях обох бензенових кілець містяться об'ємні замісники, то через просторові перешкоди вільне обертання навколо с-зв'язку, що з'єднує два цикли, стає неможливим і бензенові ядра розміщуються у взаємно перпендикулярних площинах:
їг НООС якщо принаймні хоча б в одному з бензенових кілець в орто -положеннях є однакові замісники, то така молекула має площину симетрії, а отже, вона ахі-ральна:
СООН НОО( Але якщо в орто -положеннях кожного бензенового ядра молекули біфенілу є різні замісники, молекула не має площини симетрії і стає хіральною, що, як відомо, зумовлює появу оптичної ізомерії. Так, 6,6'-динітродифенова кислота існує у вигляді двох енантіомерів:
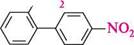
К02 НООС Дзеркальні ізомери в ряду біфенілу можна розглядати як конформери, які стали стабільними внаслідок просторових перешкод обертанню. Вид просторової ізомерії, зумовленої обмеженням вільного обертання навколо простого зв'язку, називають атропоізомерією(від грец. ахрояо — немає повороту). Для виявлення атропоізомерії необов'язковою є наявність чотирьох замісників в орто-положеннях, іноді досить трьох або навіть двох об'ємних груп. Хімічні властивості біфенілу аналогічні властивостям моноядерних аренів. Фе-нільні групи виявляють одна відносно одної слабкі електронодонорні властивості. Тому в реакції електрофільного заміщення (галогенування, нітрування тощо) біфеніл БаГатОяДернІарени З ІЗОЛЬОВаними БенЗенОВими ЦиКЛами вступає дещо легше, ніж бензен, утворюючи переважно пара- і орто-заміщені продукти. У монозаміщених біфенілу при електрофільному заміщенні новий замісник входить в незаміщене ядро:
і3 (конц.); Н28О4 (конц.) ----- ► -Н20
N0, ,N0
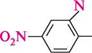
4,4' -динітробіфеніл 2,4' -динітробіфеніл Біфеніл — безбарвна кристалічна речовина (т. пл. 71 °С) зі слабким своєрідним запахом, малорозчинна у воді, добре розчиняється в органічних розчинниках. Використовується в суміші з дифеніловим етером як високотемпературний теплоносій для обігрівання хімічних реакторів та інших установок. Похідні біфенілу використовують у виробництві барвників. ДИФЕНІЛМЕТАН У молекулі дифенілметану два бензенові цикли зв'язані через метиленову групу:
Дифенілметан можна добути алкілюванням бензену бензилхлоридом або ди-хлорометаном в умовах реакції Фріделя—Крафтса:
Реакційна здатність дифенілметану зумовлена наявністю в його структурі бен-зенових циклів і активної метиленової групи. За участі бензенових кілець дифенілметан вступає в характерні для аренів реакції електрофільного заміщення, утворюючи 4,4'-дизаміщені і 2,4,2',4'-тетра-заміщені продукти: , (конц.); ___ ____________ НЧОз (конц.);
4,4' -динітродифенілметан
2,4,2' ,4' -тетранітродифенілметан Глава 16 У молекулі дифенілметану внаслідок електроноакцепторної дії фенільних груп набувають рухливості атоми Гідрогену метиленової групи. У результаті метиленова група легко окиснюється, а при галогенуванні атоми Гідрогену заміщуються на атом галогену:
[О]; СЮ3; ^
Вг бромодифенілмєтан Дифенілметан — безбарвна кристалічна речовина зі слабким приємним запахом (т. пл. 26—27°С), нерозчинна у воді, розчинна у етанолі. Використовується в парфумерній промисловості як віддушка для мила (запах герані). ТРИФЕНІЛМЕТАН Молекула трифенілметану містить три бензенові цикли, зв'язані через мети-нову групу:
Нумерацію атомів Карбону в кожному циклі виконують окремо, починаючи з атома Карбону, сполученого з метиновою групою. Трифенілметан добувають алкілюванням бензену хлороформом в умовах реакції Фріделя—Крафтса:
+ СНС1, + ЗНС1 За хімічними властивостями трифенілметан здебільшого нагадує дифенілметан. Для нього характерні реакції електрофільного заміщення за участі бензенових циклів, які проходять переважно в пара-положеннях. Унаслідок електроноакцепторної дії трьох фенільних груп у молекулі трифенілметану набуває рухливості атом Гідрогену метинової групи, який легко заміщується на метали і галогени. Так, при дії натрій аміду в рідкому амоніаку трифенілметан утворює трифенілметилнатрій, при взаємодії з хлором дає трифенілхлорометан, при окисненні утворює трифенілметанол (трифенілкарбінол):
Поиск по сайту: |
 н н о
н н о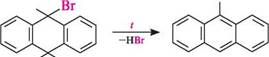
 9-бромантрацен
9-бромантрацен
 -н2о
-н2о


 -н2о
-н2о


 Вг,
Вг,


 -Н2О
-Н2О
 БАГАТОЯДЕРНІ АРЕНИ З ІЗОЛЬОВАНИМИ БЕНЗЕНОВИМИ ЦИКЛАМИ
БАГАТОЯДЕРНІ АРЕНИ З ІЗОЛЬОВАНИМИ БЕНЗЕНОВИМИ ЦИКЛАМИ




 Однак унаслідок взаємного відштовхування атомів Гідрогену в положеннях 2 і 2' мезомерна взаємодія між бензеновими циклами в біфенілі затруднена.
Однак унаслідок взаємного відштовхування атомів Гідрогену в положеннях 2 і 2' мезомерна взаємодія між бензеновими циклами в біфенілі затруднена. СООН Вг
СООН Вг
 площина симетрії
площина симетрії
 СООН О,Н, : ,.N0, НООС
СООН О,Н, : ,.N0, НООС
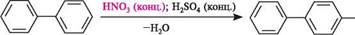

 4-нітробіфенщ
4-нітробіфенщ


 о2 од
о2 од
 -Н2О
-Н2О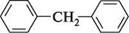
 Вг,
Вг, -НВг
-НВг

