|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
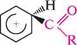
АрОматиЧнІ ВУГЛеВОДнІ. ОДНОЯДЕРШ АРЕНИ. бензенсульфокислота
Н28О4 (конц.)
+ Н2О бензенсульфокислота Сульфування аренів є оборотною реакцією. Вода, яка утворюється в процесі взаємодії, зміщує рівновагу вліво. Тому для збільшення виходу цільового продукту беруть надлишок концентрованої сульфатної кислоти або використовують олеум (розчин сульфур(VI) оксиду в сульфатній кислоті). Тонкі особливості механізму сульфування аренів вивчені недостатньо, однак більшість експериментальних даних свідчать про те, що атакуючою електрофільною частинкою в реакції слугує сульфур(VI) оксид SO3:
8О3Н
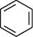
п -комплекс а-комплекс бензенсульфокислота Галогенування.Бензен і його гомологи хлоруються, бромуються і йодуються. Заміщення атома Гідрогену в бензеновому ядрі на атом Хлору або Брому здійснюють дією вільного хлору або брому в присутності каталізаторів — кислот льюїса (AlCl3, FeBr3, ZnCl2 тощо):
+ РеВг,
бромобензен НВг Під дією каталізатора, на атомі металу якого є дефіцит електронної густини, молекула галогену поляризується. Атакуючою електрофільною частинкою в цьому разі слугує або комплекс поляризованої молекули галогену з кислотою льюїса, або катіон галогену, що утворюється в процесі іонізації цього комплексу: d+ Вг—Вг + РеВг, Гб+ Вг— б- Вг РеВг,
6+ 8— Вг—Вг-^РеВг, 71-КОМПЛЄКС
а -комплекс бромобензен
Н + РеВг НВг + РеВг3
Глава 14
+ НІ Тому пряме йодування аренів проводять йодом у присутності окисників, таких як HNO3 або HgО. Роль окисника полягає в зв'язуванні йодоводню, що утворюється:
Шарль ФРІДЕЛЬ (1832-1899) Французький хімік-органік, мінералог. Основний науковий напрям — каталітичний органічний синтез. Уперше синтезував ацетофенон (1857), молочну кислоту (1861), ізопропіловий спирт (1862), гліцерин (1873), мелі-синову (1880), мезокамфорну (1889) кислоти. Разом із Крафтсом досліджував (з 1863) силіційорганічні сполуки, установив чотиривалентність Титану і Силіцію, а також розробив (1877) метод алкілювання та ацилювання ароматичних сполук відповідними алкіл- і ацилгалогенідами в присутності алюміній хлориду (реакція Фріделя — Крафтса). Штучно одержав кварц, рутин і топаз.
+ 21, + HgO
алкілювання за Фріделем—Крафтсом.Для
+ с2н5—сі хлоретан
+ с2н5—он Алкілювання аренів алкенами потребує присутності кислоти льюїса як каталізатора і мінеральної кислоти як джерела протонів. н3с—сн—сн3
Н ; AlCl н2с=сн—сн3
пропен Атакуючою електрофільною частинкою в реакції алкілювання за Фріделем— Крафтсом є карбокатіон, який утворюється в кожному конкретному випадку при взаємодії алкілюючого агента і каталізатора. арОматиЧнІ ВУГЛеВОДнІ. ОДНОЯДЕРШ АРЕНИ
СН3—СН2^С1 + А1С13 ^^ СН3—СН2 + А1С14 хлоретан іон карбонію; етил-катіон Утворення електрофілу зі спиртів: СН3—СН2—ОН + АІСІз +^ СН3—СН2—ОА1С12 ^^ СН3—СН2 + ОА1С12 —неї сн3—сн2—он + н+ +^ сн3—сн2—6—н -^ сн3—сн2 + н2о н Утворення електрофілу з алкенів: _ 32 + Н+ ^^ СН3—СН—СН3 пропен ізопропіл-катіон За своїм механізмом реакція алкілювання аналогічна розглянутим вище реакціям нітрування, сульфування і галогенування.
СН2—СН3 етилбензен Уведена в бензенове ядро алкільна група, будучи електронодонором, підвищує реакційну здатність ароматичного кільця відносно електрофільних реагентів. Тому утворений у процесі алкілювання продукт більш схильний до взаємодії з електрофілом, ніж вихідний арен. У результаті цього алкілювання часто не завершується на стадії утворення монозаміщеного продукту, а приводить до ди- і полі-алкіларенів. ацилювання за Фріделем—Крафтсом.Ацилюванням називають процес уведення в молекулу органічної сполуки ацильної групи К—С-^ . Ацилювання бензену і його гомологів за Фріделем—Крафтсом переважно здійснюють галогенангідридами або ангідридами карбонових кислот у присутності кислот льюїса. ця реакція слугує загальним методом добування ароматичних кетонів.
уіМ ДІРІ + СН3-С^ -^*- —з +НС1 чсі ^ ацетилхлорид ацетофенон Глава 14 електрофілом, який атакує бензенове кільце, у реакції ацилювання є або аци-лієвий іон К— С=О, або комплекс ацилгалогеніду з каталізатором (КСОА1С14): КСОС1 + А1С13 КСОА1С1 К—С=О + А1СП
п -комплекс к—с=о + ксооаісі;
-н а-комплекс Ацилювання ароматичного ядра, на відміну від алкілювання, перебігає переважно з утворенням монозаміщених продуктів. Ацильна група, будучи електро-ноакцепторним замісником, знижує реакційну здатність бензенового кільця відносно електрофільних реагентів. Тому диацилпохідні аренів утворюються лише в жорстких умовах. РЕАКЦІЇ ПРИЄДНАННЯ як зазначалося раніше, реакції приєднання для ароматичних вуглеводнів не характерні. Проте за жорстких умов вони все ж таки можливі. Гідрування. Бензен і його гомологи при підвищених температурі і тиску в присутності каталізаторів (найчастіше використовують нікель Ренея) приєднують три молекули водню, утворюючи циклогексан та його похідні:
циклогексан Зупинити реакцію на стадії утворення продуктів часткового гідрування (цикло-гексадієну, циклогексену) неможливо, оскільки останні гідруються значно легше за самий бензен. хлорування. При інтенсивному сонячному освітленні або при ультрафіолетовому опромінюванні бензен приєднує хлор. Реакція перебігає за радикальним механізмом з утворенням суміші стереоізомерів гексахлороциклогексану (гексахлорану) : СІ
+ ЗС12 гексахлороциклогексан РЕАКЦІЇ ОКИСНЕННЯ Окиснення бензенового циклу.Бензенове кільце дуже стійке до дії окисників. За звичайних умов такі сильні окисники, як калій перманганат, нітратна кислота, хром(VI) оксид, гідроген пероксид і такі інші, не окиснюють бензен. Але за жор-
Поиск по сайту: |

 8О3Н
8О3Н
 н+
н+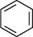



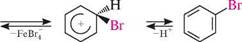



 Молекулярний йод порівняно з хлором і бромом слабкий галогенуючий агент. При взаємодії йоду з бензеном рівновага реакції практично повністю зміщена вбік вихідних речовин:
Молекулярний йод порівняно з хлором і бромом слабкий галогенуючий агент. При взаємодії йоду з бензеном рівновага реакції практично повністю зміщена вбік вихідних речовин:


 введення алкільної групи в молекулу бензену і його гомологів як електрофільні реагенти найчастіше використовують галогеналкани. Взаємодія аренів з галогеналканами відбувається в присутності каталізаторів — кислот льюїса (AlCl3, FeCl3, ZnCl2, BF3 тощо), з яких найчастіше застосовують алюміній хлорид AlCl3:
введення алкільної групи в молекулу бензену і його гомологів як електрофільні реагенти найчастіше використовують галогеналкани. Взаємодія аренів з галогеналканами відбувається в присутності каталізаторів — кислот льюїса (AlCl3, FeCl3, ZnCl2, BF3 тощо), з яких найчастіше застосовують алюміній хлорид AlCl3:
 Для алкілювання аренів, окрім галогеналканів, можуть бути використані спирти та алкени. Реакції за участю спиртів перебігають у присутності кислот льюїса або мінеральних кислот (H3PO4, H2SO4):
Для алкілювання аренів, окрім галогеналканів, можуть бути використані спирти та алкени. Реакції за участю спиртів перебігають у присутності кислот льюїса або мінеральних кислот (H3PO4, H2SO4):

 Утворення електрофілу з галогеналканів:
Утворення електрофілу з галогеналканів:




 (КСО)2О + AlCl3
(КСО)2О + AlCl3