|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
СИНТЕТИЧНІ МЕТОДИ ДОБУВАННЯ. Еріх Арманд Артур Йозеф ГЮККЕЛЬ (1896-1980)
Еріх Арманд Артур Йозеф ГЮККЕЛЬ (1896-1980) Німецький фізик і хімік-теоретик. Учень П. Й. В. Дебая.
Основний науковий напрям — розробка квантово-хімічних методів вивчення будови молекул. Пояснив (1929—1930) природу зв'язку в не-насичених і ароматичних сполуках. Висунув (1930) пояснення стійкості ароматичного секстету на основі методу молекулярних орбіталей (правило Гюккеля). ця реакція — окремий випадок реакції Вюрца стосовно аренів. як побічні продукти в процесі реакції Вюрца—Фіттіга утворюються алкани, а також дифеніл та його гомологи:
дифеніл 2СН3—СН2—Вг + 2 ,-сн, + бутан алкілювання ароматичних вуглеводнів за Фріделем—Крафтсом.Реакція Фріделя— Крафтса (1887) є загальним методом добування гомологів бензену і ґрунтується на взаємодії ароматичних вуглеводнів з алкілюючими агентами — галогеналканами, алкенами і спиртами (див. алкілювання за Фріделем—Крафтсом, с. 202). Глава 14 ФІЗИЧНІ ВЛАСТИВОСТІ За звичайних умов бензен і нижчі члени гомологічного ряду є рідинами, які мають сильний специфічний запах (табл. 14.1). Таблиця 14.1
Усі ароматичні вуглеводні нерозчинні у воді і добре розчиняються в органічних розчинниках. Багато з них найкращі розчинники для інших органічних речовин. Через високий вміст вуглецю ароматичні вуглеводні горять сильно коптявим полум'ям. Бензен дуже отруйний. Тривале вдихання його парів викликає лейкемію. ХІМІЧНІ ВЛАСТИВОСТІ Реакційна здатність бензену і його гомологів визначається переважно наявністю в структурі замкненої я-електронної системи, яка є зоною підвищеної електронної густини молекули і здатна притягати позитивно заряджені частинки — елек-трофіли. Тому ароматичні вуглеводні, як і алкени, мають нуклеофільний характер. Однак арени, на відміну від ненасичених сполук, при взаємодії з електрофільними реагентами більш схильні не до реакцій приєднання, а до реакцій заміщення, оскільки при цьому зберігається їх ароматична система. ці реакції називають реакціями електрофільного заміщення SЕ. Реакції приєднання для аренів менш характерні, тому що вони призводять до порушення ароматичності. Дуже важко вступають ароматичні вуглеводні і в реакції окиснення. 14.5.1. РЕАКЦІЇ ЕЛЕКТРОФІЛЬНОГО ЗАМІЩЕННЯ(SЕ) Бензен і його гомологи порівняно легко вступають у реакції електрофільного заміщення. електрофільна частинка, що атакує я-електронну систему бензенового кільця, може бути представлена позитивно зарядженим іоном е+ або частиною
арОматиЧнІ ВУГЛеВОДнІ. ОДНОЯДЕРШ АРЕНИ 5+ нейтральної молекули, яка має центр зі зниженою електронною густиною е Х (див. c. 115). Утворення електрофільних частинок для участі в реакції можливе різними способами — під дією я-електронної системи бензенового кільця, каталізатора, розчинника тощо. Незважаючи на велике різноманіття електрофільних реагентів і ароматичних систем, переважна більшість реакцій електрофільного заміщення в ароматичному ряду розглядається за єдиним загальним механізмом. Під час атаки електрофільною частинкою я-електронної системи бензенового кільця спочатку внаслідок електростатичної взаємодії утворюється нестійкий я-комплекс:
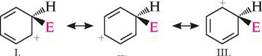
71-КОМПЛЄКС я-Комплекс є координаційною сполукою, в якій бензенове кільце — донор електронів, а електрофіл — акцептор. Утворення я-комплексу — швидка і оборотна стадія реакції. Ароматичність бензенового кільця при цьому не порушується. У багатьох випадках я-комплекс удається виявити за допомогою електронних спектрів поглинання. Поглинаючи деяку кількість енергії, я-комплекс перетворюється потім у с-комплекс (карбокатіон). На відміну від я-комплексу, у с-комплексі електрофільна частинка утворює ковалентний зв'язок з одним з атомів Карбону бензенового кільця за рахунок двох його я-електронів. При цьому відбувається порушення ароматичної системи бензенового циклу, тому що один з атомів Карбону переходить зі стану sp2- у стан sp3-гібридизації. Чотири я-електрони бензенового кільця, що залишилися, делокалізовані поміж п'ятьма атомами Карбону. Будову о-комплексу можна зобразити у вигляді резонансного гібрида структур I, II, III, але частіше його показують структурою IV:
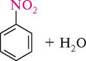
п -комплекс II. а-комплекс Утворення с-комплексу є найбільш високоенергетичною стадією реакції, яка визначає швидкість усього процесу. Перебіг електрофільного заміщення через стадію с-комплексу підтверджено численними дослідженнями. У деяких випадках с-комплекс удалося виявити спектральними методами і навіть виділити в кристалічному вигляді. Незважаючи на відносну стабільність о-комплексу за рахунок розподілу позитивного заряду поміж п'ятьма атомами Карбону, він значно менш стійкий, ніж структури з ароматичним секстетом електронів. Для того щоб набути більшої стабільності, с-комплекс відщеплює протон від атома Карбону, зв'язаного з електро-філом, і тим самим відновлює ароматичність бензенового кільця: Глава 14200Г Відновлення ароматичної структури дає виграш енергії, що становить 42 кДж/моль. До найбільш важливих реакцій електрофільного заміщення в бензеновому ядрі належать реакції нітрування, сульфування, галогенування, алкілювання та аци-лювання. нітрування.Нітруванням називають процес введення в молекулу органічної сполуки нітрогрупи —NO2. як нітруючі агенти в реакції нітрування здебільшого використовують концентровану нітратну кислоту або суміш концентрованих нітратної і сульфатної кислот (нітруюча суміш). З концентрованою нітратною кислотою арени реагують повільно, тому для їх нітрування переважно використовують нітруючу суміш:
Н,8О, (конц.); 60 °С НІчГО3 (конц.) нітробензен Атакуючою електрофільною частинкою в реакції нітрування є іон нітронію N0^, якии утворюється внаслідок кислотно-основної реакції між нітратною і сульфатною кислотами, де нітратна кислота відіграє роль основи: Н—О—КО2 + Н28О4 ^^ Н—6—N02 + Н8О4 Н протонована нітратна кислота Н—6—|Ж>2 +^ Н2О + N0+ І нітроній-іон Н2О + Н28О4 ^^ Н3О+ + Н8О; Сумарне рівняння: НО—N02 + 2Н28О4 ч=^ N0+ + Н3О+ + 2Н8О; Іон нітронію атакує я-електронну систему бензенового ядра, утворюючи нітро-похідну арену:
л-комплеко а-комплеко нітробензен Сульфування.Сульфуванням називають процес введення в молекулу органічної сполуки сульфогрупи —SO3H. Для сульфування бензену і його гомологів переважно застосовують концентровану сульфатну кислоту або димучу сульфатну кислоту (олеум). Унаслідок взаємодії утворюються аренсульфокислоти:
Поиск по сайту: |