|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ЛЕЧЕНИЕ Бужирование пищевода
В лечении послеожоговых Рубцовых стриктур пищевода основное место занимает бужирование,которое приводит к стойкому выздоровлению 70-80% больных. Различают раннее и позднее бужирование. Ранним называют бужирование, ДОБРОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ ПИЩЕВОДА 303 которое начинают еще в первой стадии ожога, с 4,8,10-го дня. Смысл его состоит в своевременном растяжении формирующихся нежных рубцов. Такое бужирование проводят ежедневно в течение месяца, постепенно увеличивая размер и время пребывания бужа в пищеводе. Затем в течение 1-2 мес сеансы бужирования проводят дважды в неделю, далее — один раз в неделю. В ряде клиник подобная методика бужирования получила широкое распространение и у детей, и у взрослых, при этом хороших результатов достигают у 90% больных. Если пациент поступает в сроки, превышающие 2 нед после ожога, такое лечение противопоказано из-за высокой опасности перфорации пищевода. Основным методом лечения данной группы больных является позднее бужирование, которое начинают не менее чем через 2 мес с момента ожога пищевода. Существует несколько наиболее распространенных методик бужирования пищевода: «вслепую», «по нити», «за нить» по Гаккеру (анте- и ретроградно через гастростому), под контролем жесткого или гибкого эндоскопа и некоторые другие способы. Самой опасной представляется методика бужирования пищевода «вслепую»: оно (а также самобужирование) чаще всего осложняется перфорацией пищевода и потому в настоящее время применяться не должно.
Наиболее прогрессивно бужирование полыми пластмассовыми рентгенокон-трастными бужами по металлической струне-проводнику. Подобные бужи являются модифицикацией поливинилхлоридных бужей «Savary-Gilliard», имеющих на дистальном конце рентгеноконтрастную маркировку. Основным их отличием является то, что рентгеноконтрастный материал в этих бужах введен в состав пластмассы, из которой они сделаны. Диаметр бужей составляет от 5 до 20 мм (от № 15 до № 40 по шкале Шарьера), длина — 70 см. По всей длине бужа проходит канал для направляющей струны. Струна-проводник представляет собой стальную проволоку диаметром 0,5-0,6 мм и длиной около 1,5 м. На конце его укреплена металлическая пружинка с полукруглой головкой, предупреждающая травму пищевода (рис. 82-3). 304 грудная хирургия Бужирование показано тем больным с ожоговыми стриктурами пищевода, у которых удается провести через зону сужения в желудок металлическую струну-проводник. Бужирование абсолютно противопоказано при рубцовых стриктурах, осложнившихся свищами пищевода (пищеводно-медиастинальные, -плевральные и -респираторные свищи). Оно также противопоказано при стриктурах, сопровождающихся резко выраженным эзофагитом, при псевдодивертикулезе пищевода (опасность перфорации), подозрении на малигнизацию стриктуры. Бужирование по металлической струне-проводнику проводят в рентгенологическом кабинете с телевизионным монитором. Премедикации обычно не требуется. Пациент сидит перед рентгеновским экраном. Прежде чем приступить к первому сеансу бужирования, можно дать больному выпить глоток контрастного вещества, чтобы еще раз проконтролировать ход стриктуры. Сначала под рентгенологическим контролем проводят через стриктуру в желудок струну-проводник, затем по ней смазанный вазелиновым маслом буж (рис. 82-4). Диаметр первого бужа подбирают в соответствии с рентгенограммой. Обычно начинают с бужа № 18-20 по шкале Шарьера. Если он проходит свободно, его удаляют, не вынимая струны-проводника, и тут же проводят буж следующего размера. Стремятся довести курс бужирования до бужа № 40, соответствующего диаметру нормального пищевода.
Форсированное бужирование рубцовых стриктур иногда в самом начале лечения может вызывать обострение эзофагита, лечению которого следует придавать серьезное значение. При резко выраженном эзофагите бужирование временно прерывают, прием пищи, за исключением жидкости, прекращают на 2-3 дня. Питание пациента в это время осуществляют парентеральным путем (если нет гастростомы). Назначают прием растительного масла или рыбьего жира по столовой ложке 4-6 раз в день. С помощью таких простых мероприятий обычно удается ликвидировать или значительно уменьшить явления эзофагита и затем продолжить бужирование. ДОБРОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ ПИЩЕВОДА 305 В процессе лечения, когда пищевод расширен до бужа № 28-30, выполняют повторное полноценное рентгеноконтрастное исследование как с жидкой, так и с густой бариевой взвесью, чтобы точно выяснить состояние желудка (возможность его ожогового поражения). При эксцентрично расположенном входе в стриктуру могут возникнуть трудности при проведении струны-проводника. В таких случаях первые сеансы бужи-рования осуществляют по той же методике, но под контролем фиброэзофагоскопа. При этом сначала через стриктуру в желудок вводят эндоскоп малого диаметра (0,5-0,6 см), через его биопсийный канал проводят направляющую струну, эндоскоп извлекают и по струне проводят бужирование полыми рентгеноконтрастны-ми бужами (первый способ). При втором способе бужирования, когда эндоскоп провести через сужение не удается, его устанавливают над входом в стриктуру и под визуальным контролем в просвет стриктуры вводят струну-проводник. Если нет уверенности в том, что струна прошла в желудок, делают рентгенологический контроль и только потом проводят бужирование. Таким образом, эндоскопическое бужирование также проводят в условиях рентгеновского кабинета. Подобная методика бужирования может понадобиться и у больных с повышенным рвотным рефлексом и лабильной психикой, когда возникают затруднения при проведении даже направляющей струны. Эндоскопическое бужирование по струне-проводнику можно проводить и ретроградно (если обычным способом направляющую струну провести через стриктуру по каким-либо причинам не удается) — через гастросто-му, если таковая уже имеется. Для расширения рубцовых стриктур пищевода в последнее время используют вибробужирование с помощью специальных аппаратов, которое проводят двумя способами — вибрирующим пластмассовым бужом или эксцентрично вращающимся вокруг своей оси металлическим цилиндром. Благоприятное влияние на ожоговые стриктуры пищевода оказывает гипер-баротерапия. Курс гипербарической оксигенации, проводимый одновременно с бужированием, способствует рассасыванию свежих рубцов, более легкому их растяжению бужами. Эффективность бужирования зависит от многих факторов, большую роль играет протяженность стриктуры. Так, при коротких стриктурах (протяженностью не более 5 см) стойкого выздоровления удается добиться у 85-90% больных. При таких вариантах ожоговых стриктур, кроме бужирования, хороший эффект оказывает также эндоскопическая баллонная гидростатическая дилатация. Необходимо отметить, что ее можно проводить и при протяженных стриктурах, поэтапно расширяя один участок стриктуры за другим. Для профилактики рестеноза после окончания курса эндоскопического лечения доброкачественных рубцовых стриктур у некоторых пациентов применяют также временное эндопротезирование пищевода. Хирургическое лечение До 40% больных с протяженными Рубцовыми стриктурами пищевода нуждаются в оперативном лечении. Особенно плохо поддаются лечению с помощью бужирования субтотальные и тотальные рубцовые стриктуры. При вторичном укорочении пищевода и присоединении к основному заболеванию рефлюкс-эзофагита такое лечение становится бесперспективным и его можно проводить только в качестве предоперационной подготовки для улучшения алиментарного статуса больного. Показания к оперативному лечению: • полная ожоговая стриктура пищевода; • невозможность провести буж больше № 28-30; • укорочение пищевода с развитием вторичной кардиальной грыжи пищевод 306 грудная хирургия • быстрые рецидивы дисфагии (через 3-6 мес) после повторных курсов бужи- • сочетание ожоговой стриктуры пищевода, глотки и желудка; • ожоговые стриктуры, осложненные пищеводными свищами; • все перечисленные выше противопоказания к бужированию. Выбор метода эзофагопластики зависит от многих условий: степени, локализации и протяженности стриктуры; наличия осложнений и сопутствующих ожоговых поражений глотки и желудка; предыдущих операций (гастростомии, гастроэнтеростомии, резекции желудка, попыток эзофагопластики и пр.); возраста и общего состояния больного. Эзофагопластикав силу разных причин может быть одномоментной и многоэтапной. Так, например, у истощенных пациентов оправдано первым этапом наложение гастростомы для полноценного питания в целях эффективной подготовки к эзофагопластике. При ожоговом стенозе выходного отдела желудка в качестве первого этапа может быть использована пилоро-пластика, гастродуоденостомия или экономная резекция желудка в сочетании с гастростомиеи. Само создание искусственного пищевода также иногда приходится разбивать на несколько этапов, например, сначала формируют трансплантат с укладыванием его в подкожном туннеле вследствие сомнений в адекватности кровоснабжения или из-за недостаточной длины, а затем выполняют ремобилизацию и соединение трансплантата с пищеводом на шее или в плевральной полости. Более предпочтительны, безусловно, одномоментные операции. В зависимости от протяженности и локализации стриктуры, длины выкраиваемого трансплантата различают местную, сегментарную, субтотальную и тотальную пластику пищевода. При короткой (<1,5-2 см) стриктуре необходимо попытаться использовать местную пластику.Могут быть использованы различные варианты операций, например, циркулярная резекция стриктуры с эзофаго-эзофагоанастомозом «конец в конец» или продольное рассечение с ушиванием раны пищевода в поперечном направлении (рис. 82-5). При протяженной рубцовой стриктуре показано замещениеили шунтирование обожженного пищевода.В качестве трансплантата в настоящее время используют как желудок, так и различные сегменты тонкой и толстой кишки. В зависимости от локализации и протяженности стриктуры анастомоз пищевода с трансплантатом может быть сформирован в грудной полости или на шее. Трансплевральная резекция стриктуры или обходное ее шунтирование сопровождаются более значительным количеством легочно-сердечных осложнений и опасны фатальным исходом в случае несостоятельности анастомоза. Субтотальная и тотальная подкожная или загрудинная пластика требуют формирования длинного трансплантата, что делает актуальной проблему его достаточного кровоснабжения (опасность некроза). Анатомо-физиологические особенности тонкой кишки делают ее во многом подходящей для создания искусственного пищевода. Она имеет достаточный диаметр и большую длину, обладает хорошей перистальтической активностью. Кровоснабжение тонкой кишки обеспечивается системой верхней брыжеечной артерии. У большинства людей первые пять-семь ее кишечных ветвей анастомо-зируют друг с другом путем сосудистых аркад. Пересечение 2-4-го, а иногда и 5-го сосудов у места их ответвления от верхней брыжеечной артерии с сохранением сосудистых аркад позволяет сформировать изоперистальтический трансплантат из тощей кишки для субтотальной и тотальной эзофагопластики. При этом тощую кишку пересекают в 10-20 см от связки Трейтца, первый кишечный сосуд чаще оставляют непересеченным ввиду особенностей его ветвления. Длину будущего трансплантата измеряют, используя толстую нить или тесьму, при этом укладывают ее вдоль края рассеченной брыжейки, а не кишки, которая в силу понятных причин всегда оказывается длиннее брыжейки. Оральный конец пересеченной ДОБРОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ ПИЩЕВОДА 307
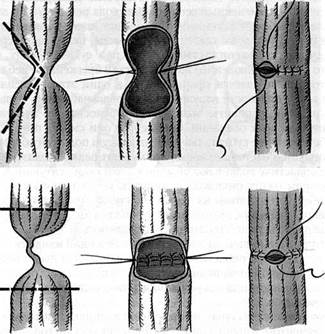
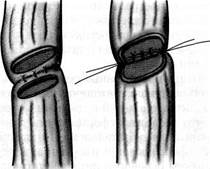
Рис. 82-5. Основные виды местной эзофагопластики при коротких стриктурах: а — продольное (под углом) рассечение зоны сужения с последующим сшиванием в поперечном направлении; б — резекция с наложением анастомоза «конец в конец»; в — наложение анастомоза без резекции пищевода. вблизи связки Трейтца тощей кишки анастомозируют с тонкой кишкой ниже основания трансплантата по типу «конец в бок». Если не удается сформировать трансплантат достаточной длины, его укладывают в подкожный туннель, выводя верхний конец на кожу груди в виде энтеросто-мы. В последующем (через 3-4 мес) возможны ремобилизация трансплантата из подкожного туннеля и наложение анастомоза на шее. В зависимости от протяженности стриктуры возможен вариант формирования анастомоза с пищеводом в плевральной полости, куда кишечный трансплантат ГРУДНАЯ ХИРУРГИЯ проводят через расширенное пищеводное отверстие диафрагмы. По методике А.Г. Савиных рубцово измененный сегмент пищевода резецируют в заднем средостении и там же формируют анастомоз. Применяют также проведение кишечного трансплантата и на шею в ложе удаленного пищевода, т.е. в заднем средостении. Тонкокишечная эзофагопластикаимеет ряд существенных недостатков. Довольно часто (до 1/ъ наблюдений) из-за короткой брыжейки и неблагоприятной ангиоархитектоники не удается сформировать в один этап трансплантат достаточной длины ввиду опасности нарушения его кровоснабжения. Вследствие этого нередки случаи, когда пациенты вынуждены переносить по несколько (иногда много) реконструктивных операций, прежде чем они смогут питаться через рот. В силу этих обстоятельств субтотальную и тотальную подкожную пластику пищевода тонкой кишкой в настоящее время применяют редко. Показания к тонкокишечной эзофагопластике возникают обычно в следующих ситуациях. • При тотальном ожоге пищевода и желудка, когда тонкую кишку выводят в • После экстирпации пищевода и желудка (также в один или несколько этапов). • При повторной эзофагопластике, когда предыдущая попытка пластики пище В ряде случаев при стриктурах шейного отдела пищевода применяют пластику коротким сегментом тонкой кишки на длинной сосудистой ножке. При этом трансплантат выкраивают по тем же принципам, но избыток кишки удаляют, перевязывая и пересекая прямые сосуды непосредственно по ее брыжеечному краю. Наиболее прогрессивным методом сегментарного замещения пищевода является свободная пересадка участка тонкой кишки на микрососудистых анастомозах, которую обычно осуществляют на шее, реже — в грудной полости. При этом артерию и вену трансплантата анастомозируют с подходящими по диаметру близлежащими сосудами. Чаще всего при протяженных послеожоговых стриктурах пищевода в настоящее время используют толстокишечную пластику пищевода.Преимущества толстой кишки, особенно левой ее половины, состоят в магистральном типе кровоснабжения, что позволяет сформировать трансплантат практически любой необходимой длины для субтотальной и тотальной пластики пищевода. Трансплантат может быть сформирован в изо- или антиперистальтической позиции в зависимости от выбора основного питающего сосуда, который осуществляют во время операции путем пробного пережатия и визуальной оценки пульсации коротких артерий в области будущего орального конца трансплантата (рис. 82-6). Толстокишечный трансплантат вместе с питающей ножкой проводят за желудком, а затем на шею (чаще всего в загрудинном туннеле), нижний конец искусственного пищевода анастомозируют с желудком или его культей, иногда — с тощей или двенадцатиперстной кишкой, верхний — с шейным отделом пищевода или глоткой (рис. 82-7). Остатки толстой кишки соединяют между собой анастомозом «конец в конец» с проведением их через «окно» в брыжейке тонкой кишки, чтобы избежать натяжения анастомоза (рис. 82-8). Возможны также варианты проведения трансплантата на шею под кожей груди или в заднем средостении в ложе удаленного пищевода, а также внутриплевраль-ная сегментарная эзофагопластика, которую применяют ограниченно из-за повышенного риска тяжелых сердечно-легочных и инфекционных осложнений. Так же как и в случае с тонкой кишкой, при коротких стриктурах пищевода может быть применена толстокишечная сегментарная пластика трансплантатом ДОБРОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ ПИЩЕВОДА 309
Рис. 82-6. Варианты выкраивания толстокишечного трансплантата из различных участков левой половины ободочной кишки в зависимости от типа ее кровоснабжения: а — использование левой половины ободочной кишки; б — использование левой половины толстой кишки вместе с поперечно-ободочной кишкой.
Рис. 82-7. Варианты проведения толстокишечного трансплантата на шею: а — подкожно антетора-кально; б — ретростернально; в — в заднем средостении. 310 ГРУДНАЯ ХИРУРГИЯ
Рис. 82-8. Ножка трансплантата расположена позади желудка, оставшиеся участки толстой кишки проведены через «окно» в корне брыжейки тонкой кишки и соединены анастомозом «конец в конец». на длинной сосудистой ножке или свободная пересадка участка кишки на микрососудистых анастомозах. Наконец, при ожоговых стриктурах пищевода все шире применяют формирование искусственного пищевода из желудка.Используют как целый желудок, так и выкроенные из него трубчатые трансплантаты. Желудочная эзофагопла-стика может быть, так же как и кишечная, сегментарной (внутриплевральной) и субтотальной или тотальной. Желудок в качестве материала для эзофагопластики обладает рядом существенных преимуществ. Хорошее устойчивое кровоснабжение позволяет, используя ряд приемов наряду со специальными инструментами и сшивающими аппаратами, сформировать из большой кривизны изо- или антиперистальтический трубчатый трансплантат любой необходимой длины (рис. 82-9). Пассаж пищи после этого вида пластики является более физиологическим, обеспечивается участие в акте пищеварения всех отделов кишечника. Формируется только один анастомоз с пищеводом, тем самым устраняется опасность многих осложнений. Желудочную трубку помещают обычно в заднем средостении в ложе удаленного пищевода, но используют также и ретростернальный путь. Всю операцию чаще всего выполняют из трансдиафрагмального (трансхиатального) и шейного доступов, без торакотомии. Это предупреждает развитие многих легочно-сердечных осложнений. Вместе с тем в случае тяжелого периэзофагита (скле-розирующего медиастинита) для более безопасной мобилизации пищевода под визуальным контролем бывает необходима торакотомия. Вынесение анастомоза с пищеводом на шею при данном виде эзофагопластики делает гораздо менее опасной возможную его несостоятельность. Такие случаи заканчиваются наружным свищом, который обычно хорошо заживает в результате консервативного лечения. ДОБРОКАЧЕСТВЕННЫЕ ЗАБОЛЕВАНИЯ ПИЩЕВОДА 311
Рис. 82-9.Схема пластики пищевода изоперистальтическим желудочным трансплантатом, выкроенным из большой кривизны с кровоснабжением за счет правой желудочно-сальниковой артерии: а — выкраивание желудочной трубки для эзофагопластики; б — анастомоз желудочного трансплантата с пищеводом; в — дренирование средостения и брюшной полости на заключительном этапе операции. Рентгенологический контроль анастомоза с водорастворимым контрастным веществом осуществляют на 5-е сутки после операции. К сожалению, использовать желудок для эзофагопластики удается не всегда из-за предшествовавших операций, таких как гастроэнтеростомия или резекция желудка. Грубо сформированная гастростома на большой кривизне с повреждением сосудистой аркады также может явиться непреодолимым препятствием к желудочной эзофагопластике. Чтобы избежать подобной ситуации, предлагают формировать гастростому по Витцелю (если она необходима в качестве первого этапа у истощенного больного) на передней стенке тела желудка ближе к малой кривизне после предварительной ее мобилизации по типу селективной проксимальной ваготомии. Мобилизованную таким образом малую кривизну можно легко подтянуть и подшить к передней брюшной стенке (рис. 82-10). Затем при выполнении эзофагопластики вторым этапом не составляет большого труда сформировать желудочный трансплантат из полностью сохраненной большой кривизны. При выкраивании изоперистальтической желудочной трубки гастростома вместе с малой кривизной и кардией отходят в препарат. Результаты эзофагопластики желудочной трубкой с анастомозом на шее при Рубцовых ожоговых стриктурах в большинстве случаев хорошие.
Рис. 82-10.Схема гастросто-мии по А.Ф. Черноусову: а — скелетизация малой кривизны; б — наложение гастростомы. ГРУДНАЯ ХИРУРГИЯ
Поиск по сайту: |