|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
СУЛЬФУрОрГанІЧнІ СПОЛУКи. Амідування
Амідування ІЧНСОСН, + N11, 8О2С1 и-ацетамідобензен-сульфамід
Гідроліз 8О2]ЧН2 + НОН іґ + снхоон 802>Ш2 и-амінобензен-сульфамід Для захисту аміногрупи від побічних реакцій, що відбуваються при сульфо-хлоруванні, попередньо анілін ацилюють. як ацилюючий реагент найчастіше використовують оцтовий ангідрид. Ацетанілід, який утворюється, потім піддають сульфохлоруванню. Сульфохлоруванням називають процес введення в молекулу органічної сполуки хлоросульфонільної групи —SO2Cl. Сульфохлорування здійснюють дією хлоросульфонової кислоти HOSO2Cl. При взаємодії ацетаніліду з хлоросульфоновою кислотою утворюється п-ацетамідобензенсульфохлорид (хлорангідрид п-ацетамідобензенсульфокис-лоти), який обробляють амоніаком. Унаслідок реакції з амоніаком атом галогену в хлоросульфонільній групі заміщується на аміногрупу і утворюється п-ацетамідобензенсульфамід, який потім піддають гідролізу в кислому середовищі з метою зняття ацетильного захисту. У процесі гідролізу утворюється п-амінобензенсульфамід (стрептоцид). На відміну від сульфанілової кислоти її амід амфотерна сполука, здатна утворювати солі як з мінеральними кислотами, так і з лугами: нсі 5О21ЧН2
8О2НН2 и-сульфаміланіліній хлорид
-Н,0 натрій и-амінобензенсульфонамід За допомогою заміщенням атомів Гідрогену в сульфамідній групі молекули стрептоциду різними радикалами, які частіше мають гетероциклічну природу, одержано чималу групу лікарських препаратів, що мають антимікробну активність: Глава 29
сульфацил; альбуцид норсульфазол; сульфатіазол
8О2ІчГН сульфаметоксазол етазол; сульфаетидол
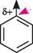
СН3О сульфален При взаємодії сульфонілхлоридів зі спиртами або алкоголятами добувають естери (сульфонати): О К—8 —СІ + Йаб—С2Н5 О О К—8 —О—С2Н5 + О етилсульфонат Зазвичай естери п-бромобензенсульфонової кислоти загальної формули п-BrС6H4SO2OR називають брозилатами, п-толуенсульфонової кислоти — този-латами (п-CH3C6H4SO2OR), трифлуорометансульфонової кислоти — трифлатами (CF3SO2OR). Наведені сульфонати виявляють найсильніші алкілюючі властивості, тому що в реакціях SN утворюють стабільні групи, які швидко зникають (аніони відповідних сульфонових кислот). нуклеофільне заміщення сульфогрупи (SN). Сульфогрупа має тетраедричну будову і практично не вступає в кон'югацію з я-електронами ароматичної системи. Слід також ураховувати, що сульфування є оборотним процесом. Тому при дії сильних нуклеофільних реагентів можливе заміщення сульфогрупи іншими функціональними групами. Перебігу реакцій нуклеофільного заміщення сульфогрупи сприяють також дефіцит електронної густини на атомі Карбону ароматичного кільця. 8О3Н
Гідроліз аренсульфонових кислот (десульфування). Реакцію використовують для видалення з ароматичного кільця сульфогрупи.
Поиск по сайту: |



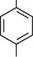



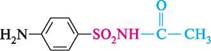
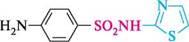

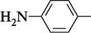



 сульфадимезин; сульфадимідин
сульфадимезин; сульфадимідин