 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Окиснення тіолів (див. с. 501).
Взаємодія алкілгалогенідів з гідросульфітами та сульфітами лужних металів (амонію).У лабораторних умовах алкансульфокислоти одержують при взаємодії галогеналканів з натрій гідросульфітом або амоній сульфітом. С2Н5—Вг + КаН8О3 —► С2Н5—8О3№ + НВг натрій етансульфонат С2Н5—Вг + (КН4)28О3 -*-► С2Н5— амоній етансульфонат Подальше підкислення розчинів приводить до виділення сульфокислот. Взаємодія альдегідів і кетонів з гідросульфітами лужних металів.Унаслідок ну-клеофільного приєднання гідросульфіт-іона до альдегідів і метилкетонів з високим виходом утворюються а-гідроксисульфонові кислоти. ?н СН3—СН2—с'+ КаН8О3 —► СН3—СН2—СН— ті 1 -гідроксипропансульфонат ОН —► СН3—СН2—СН—8О3Н 1-гідроксипропансульфонова кислота ОН СН3—СН2—С—СН3 + КаН8О3 —► СН3—СН2—С —8О3Ка бутанон натрій 1-гідрокси- 1 -метилпропансульфонат ОН СН3—СН2—С —8О3Н сн3 1 -гідрокси-1 -метилпропан-сульфонова кислота Глава 29 506Г Сульфування ароматичних вуглеводнів(див. с. 200, 219, 224) — найкращий спосіб добування аренсульфокислот. БУДОВА СУЛЬФОГРУПИ Сульфогрупа —SO3H має тетраедричну будову. В аніонах сульфонових кислот негативний заряд делокалізований між трьома атомами Оксигену. 0,182 нм С6Н5
_Ч7з шу 28' За октетною теорією атом Сульфуру в сульфогрупі утворює два ковалентні і два семіполярні зв'язки (структура I). Однак використовується і структура II, тому що в атома Сульфуру є вільні 3d-орбіталі, на яких можуть розташовуватися додаткові електрони інших атомів, у тому числі й атома Оксигену. як наслідок d+ d- цього утворюються зв'язки S= O.
Справжня будова сульфогрупи відповідає проміжному стану між граничними структурами I і II. ХІМІЧНІ ВЛАСТИВОСТІ Сульфогрупа чинить на вуглеводневий радикал сильну електроакцепторну дію (—I-, — Л/-ефекти). Унаслідок значної електронегативності атома Сульфуру зв'язок С—S сильно полярний. Для сульфокислот характерні такі групи реакцій: > реакції за участі сульфогрупи (утворення солей, галогенангідридів, амідів, > нуклеофільне заміщення сульфогрупи (SN); > електрофільне заміщення (SE) по ароматичному ядру. реакції за участі сульфогрупи. Кислотні властивості. Сульфонові кислоти виявляють кислотні властивості, які за силою можна порівнювати з властивостями мінеральних кислот. Значення рКа сульфонових кислот змінюються в тому ж інтервалі, що і значення рКа сильних мінеральних кислот (-5,0.-8,0). Сульфокислоти утворюють солі (сульфонати) з лужними, лужноземельними металами, їх оксидами та гідроксидами. К—8О3Н + КаОН —► К—8О3Ма+ Н2О натрій сульфонат При взаємодії сульфокислот з галогенуючими реагентами (PCl3, PCl5, SOCl2 тощо) утворюються сульфонілхлориди: СУЛЬФУрОрГанІЧнІ СПОЛУКи
к—8—он + рсі5 —► к—8—сі + росі3 + на сульфонілхпорид Для добування аренсульфонілхлоридів також використовують хлоросульфонову кислоту.
бензен- бензен- сульфокислота сульфонілхлорид Ароматичні сульфонілхлориди порівняно з аліфатичними менш активні. Сульфонілхлориди широко використовують в органічному синтезі амідів, естерів тощо. Сульфонаміди та їх похідні одержують при взаємодії сульфонілхлоридів з амоніаком або амінами. К— 8О2С1 + 2>Шз —► К—8О21ЧН2 + 1ЧН4С1 сульфонамід Ароматичні сульфонаміди виявляють слабкі кислотні властивості і розчинні в лугах. Аг — 5—N ^5- Н £^в- Сульфонамід-аніон, що утворюється, виявляє нуклеофільні властивості. При хлоруванні натрій бензенсульфонаміду одержують бензенсульфондихлор-амід (дихлорамін Б), який є сильним окисником і використовується для дезінфекції і дегазації отруйних речовин.
2НОС1
о дихлорамін Б Дезінфікуючі властивості виявляють також і інші хлораміни.
О СІ хлорамін Т Глава 29 Серед аренсульфонамідів виділяють численну групу лікарських препаратів антибактеріальної дії — сульфаніламіди. Структурним фрагментом сульфаніламідів є сульфанілова кислота (див. с. 296). Наявність у молекулі сульфанілової кислоти кислотного (група —SO3H) і основного (група —H2) центрів зумовлює її існування у вигляді внутрішньої солі (біполярного іона)
Сульфанілова кислота — досить сильна кислота (рКa = 3,22), реагуючи з основами, легко утворює солі:
+ НОН натрій л-амінобензенсульфонат Через біполярну структуру сульфанілова кислота не утворює солей з мінеральними кислотами, тобто, незважаючи на наявність аміногрупи, вона не має основних властивостей. Родоначальником сульфаніламідних препаратів є амід сульфанілової кислоти, застосовуваний у медичній практиці за назвою «Сульфаніламід» або «Стрептоцид»: О
О сульфаніламід; стрептоцид; амід сульфанілової кислоти Схема синтезу стрептоциду:
Ацилювання + (СН3СО)2О 1ЧНСОСН, + СН3СООН ацетанцпд
Сульфохлорування ЇЧНСОСН, + НО8О2С1 МІСОСН, + н2о
хлоросульфонова кислота 8О2С1 и-ацетамідобензен-сульфохлорид
Поиск по сайту: |

 о о
о о

 8О2ОН 8О2С1
8О2ОН 8О2С1 -неї
-неї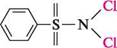 О О
О О


 0
0






