|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
СУЛЬФУрОрГанІЧнІ СПОЛУКи
ТІОЛИ Тіолами називають похідні вуглеводнів, у молекулах яких один або кілька атомів Гідрогену заміщені меркапто групою —SH. Меркаптогрупу ще називають тіольною, або сульфгідрильною групою. Тіоли можна також розглядати як тіоаналоги гідроксильних похідних вуглеводнів, у молекулах яких атом Оксигену групи —OH замінений на атом Сульфуру. Для сполук цього класу використовують ще назву «меркаптани». Тіоли, в яких меркаптогрупа зв'язана з аліфатичним радикалом, називають тіо-спиртами, а з ароматичним радикалом — тіофенолами:
С2Н5—8Н тіоспирт тіофенол Номенклатура тіолів аналогічна номенклатурі гідроксильних похідних з тією лише різницею, що замість суфікса -ол використовується суфікс -тіол або замість префікса гідрокси- застосовується префікс меркапто-: СН3— 8Н метанпол; метилмеркаптан СН3— СН2— §N£1 натрій егантіолят; натрій етилмеркаптвд Н8—СН2—СН2—8Н 1,2-етандитіол
8Н
тіофенол; меркаптобензен 8Н
сн3 2-метилтіофенол 8Н
8Н 1,2-димеркаптобензен Тіоли, за винятком метантіолу,— рідкі або тверді речовини. як правило, їхні температури плавлення і кипіння нижчі від гідроксианалогів, що пов'язано з меншою електронегативністю атома Сульфуру порівняно з атомом Оксигену і відповідно до цього меншою схильністю до утворення водневих зв'язків. Через це тіоли порівняно зі спиртами та фенолами гірше розчиняються у воді. Здебільшого меркаптани отруйні і мають надзвичайно неприємний запах. СПОСОБИ ДОБУВАННЯ Взаємодія галогеналканів з гідросульфідами лужних металів.При дії на первинні і вторинні галогеналкани калій або натрій гідросульфіду утворюються тіоспирти. Реакція перебігає за механізмом SN (див. с. 252):
с2н5—сі хлоретан Реакція неможлива з третинними галогеналканами, тому що в цьому разі переважає процес елімінування. Взаємодія спиртів із гідросульфідом.При обробці спиртів гідросульфідом (сірководнем) у присутності каталізатора Al2O3 при температурі 350—400°С утворюються тіоспирти: Глава 29
С2Н5—ОН Н28 А12О3; І *► С2Н5—8Н+ НОН У реакцію вступають лише первинні спирти. Відновлення аренсульфокислот і аренсульфонілхлоридів.При відновленні арен-сульфокислот і аренсульфонілхлоридів утворюються тіофеноли. як відновник використовують цинк у розчині сульфатної кислоти або літій алюмогідрид LiAlH4: 8Н
[Н]; кат.
бензенсульфокислота
[Н]; кат.
бензенсульфохлорид тіофенол ХІМІЧНІ ВЛАСТИВОСТІ За хімічними властивостями тіоли багато в чому подібні до гідроксильних похідних вуглеводнів. Особливості їхньої хімічної поведінки зумовлені зменшенням міцності зв'язку S—Н порівняно зі зв'язком O—H у спиртах і фенолах. Саме тому тіоли мають більш виражені кислотні властивості, ніж відповідні їм гідро-ксианалоги (див. с. 92). Реакції тіолів переважно зумовлені іонізацією зв'язку S—H / нуклеофільними властивостями атома Сульфуру. Утворення тіолятів (меркаптидів).Тіоли, як більш сильні кислоти, ніж аналогічні OH-кислоти, легко утворюють солі — тіоляти (меркаптиди) не тільки з лужними металами, але також і з іонами важких металів:
С2Н5—8Н + 2С2Н5—8Н Н§ С2Н5— натрій етантіолят (С2Н5— 8)2Н§ меркурій(П) етантіолят Н2О 2Н+ На цій властивості тіолів ґрунтується їхнє застосування в медицині як анти-доти при отруєнні важкими металами. Взаємодія тіолівз алкенами.У присутності пероксидів або під дією УФ-випромінювання тіоли приєднуються до алкенів за місцем розриву подвійного зв'язку з орієнтацією всупереч правилу Марковникова. Реакція перебігає за механізмом AR: ,,о СН3—8—Н Н2С=СН— СН3 оон 8 СН2 СН2 СН метантіол пропен метилпропілсульфід ацилювання тіолів.Реакція тіолів з карбоновими кислотами каталізується сильними кислотами і приводить до утворення тіоестерів карбонових кислот: СУЛЬФУрОрГанІЧнІ СПОЛУКи СН3—С+ Н5—С2Н5-^ СН3—С + Н2О ОН 8— С2Н5 оцтова кислота етантіол етиловий естер тіооцтової кислоти ця реакція аналогічна реакції естерифікації карбонових кислот і спиртів (див. с. 411). Окиснення тіолів.На відміну від спиртів, тіоли окиснюються не по атому Карбону, а по атому Сульфуру. Утворення продуктів реакції залежить від умов окиснення. При окисненні тіолів у м'яких умовах (H2O2, CuCl2 тощо) утворюються діал-кілдисульфіди: К—8—Н + О + Н—8—К ------------- ► К—8—8—К + Н2О діалкілдисульфід При окисненні тіолів сильними окисниками (KMnО4, HNO3 або HOI) утворюються сульфокислоти: К—8—Н О тіол сульфонова кислота; сульфокислота ОКРЕМІ ПРЕДСТАВНИКИ. ВИКОРИСТАННЯ метантіол(метилмеркаптан) СН3—SH. Безбарвний газ з неприємним запахом, розчинний у воді, спирті, етері (т. кип. 5,95°С). Добувають взаємодією метанолу із гідросульфідом у паровій фазі в присутності каталізатора. Використовують у виробництві лікарського препарату метіоніну, як одорант для палива, у тому числі побутового газу (поріг запаху 2,1 • 1СГ8 мг/л). тіофенол(фенілмеркаптан) С6Н5—SH. Безбарвна рідина з неприємним запахом, нерозчинна у воді, легкорозчинна в органічних розчинниках (т. кип. 169°С). Здобувають при відновленні бензолсульфохлориду цинком у сульфатній кислоті. Використовують у виробництві інсектицидів; як компонент віддушок у харчовій промисловості і парфумерії. Ряд сполук, що містять у своєму складі меркаптогрупу, застосовують у медичній практиці: мерказоліл (див. с. 560), меркаптопурин (с. 608) і т. ін. СУЛЬФІДИ Сульфіди (тіоетери) можна розглядати як похідні гідросульфіду Н2S, у молекулі якого два атоми Гідрогену заміщені вуглеводневими радикалами. Сульфіди є аналогами етерів. Загальна формула сульфідш К—S—К'. Глава 29 Назви сульфідів за радикало-функціональною номенклатурою зазвичай утворюють від назв вуглеводневих радикалів R і К' (за алфавітним порядком) і слова сульфід. За замісниковою номенклатурі ШРАС сульфіди розглядають як похідні вуглеводнів, в яких один з атомів Гідрогену заміщений R-тіогрупою. За родоначальну структуру обирають складніший за будовою радикал.
СН3— СН2— 8 — СН2— СН3 5—С2Н5
діегилсульфід; етилтіоетан етилфенілсульфід; етилтіобензен СПОСОБИ ДОБУВАННЯ алкілювання тіолятів. цей метод аналогічний синтезу етерів за Вільямсоном: С2Н5—Вг + №8 — СН3 —► С2Н5—8 —СН3+ №Вг етилметилсульфід Симетричні сульфіди одержують дією натрій сульфіду на галогеналкани:
С2Н5—8 —С2Н5 + 2ШВГ діегалсульфід Взаємодія сульфур галогенідів з аренами. Для добування діарилсульфідів використовують реакцію електрофільного заміщення в аренах. як електрофільний реагент використовують сульфур галогеніди в присутності кислот льюїса:
+ 82С12 + 2НС1 + 8 дифенілсульфід Сульфіди — це безбарвні речовини з неприємним запахом. Вони практично не розчиняються у воді. ХІМІЧНІ ВЛАСТИВОСТІ Сульфіди за своїми хімічними властивостями дуже нагадують етери. Проте для них характерні особливості, пов'язані з більшою поляризованістю атома Сульфуру порівняно з атомом Оксигену. Утворення солей сульфонію. Сульфіди, як і етери, є слабкими основами. Вони здатні протонуватися в кислому середовищі. При взаємодії сульфідів з концентрованою сульфатною кислотою утворюються солі сульфонію: К—8—К' Н28О4 К—8—К' Н8о: н сульфід сіль сульфонію алкілювання сульфідів. Сульфіди порівняно легко реагують з галогеналканами з утворенням достатньо стабільних триалкілсульфоній галогенідів: СН3І ^
СН3—8 —СН3 диметилсульфід триметилсульфоній йодид СУЛЬФУрОрГанІЧнІ СПОЛУКи Окиснення сульфідів.Продукти окиснення сульфідів залежно від природи окисників і умов реакції можуть бути різними. Так, при окисненні сульфідів йодидною кислотою при 0 °С утворюються сульфоксиди: К—8—К' сульфоксид Подальше окиснення сульфоксидів приводить до утворення сульфонів: о К—8 —К' О О сульфон Взаємодія сульфідів із солями важких металіввідбувається легко і приводить до утворення комплексів: К28 + Н§С12 —► К28-Н§С12 діалкіл- сулема комплексна сульфід сполука ця особливість дозволяє використовувати деякі сульфіди як антидоти при отруєнні солями важких металів. Реакція також застосовується в аналізі для ідентифікації сульфідів. ОКРЕМІ ПРЕДСТАВНИКИ. ВИКОРИСТАННЯ ДиметилсульфідCH3— S— CH3. Безбарвна летка рідина з неприємним запахом (т. кип. 38°С). Синтезують з метанолу і сірководню в присутності каталізатора. Використовують для виробництва диметилсульфоксиду. Іприт(Р,|3'-дихлородіетилсульфід) ClCH2CH2—S—CH2CH2Cl. Безбарвна кристалічна речовина (т. кип. 157°С), важкорозчинна у воді, добре — в органічних розчинниках. Технічний іприт — бурувата рідина з запахом гірчиці. Надзвичайно отруйний. Іприт — бойова отруйна речовина (БОР) шкірно-наривної та загальноток-сичної дії, протиплазматична отрута. як БОР був уперше використаний Німеччиною 1917 року біля бельгійського міста Іпр (звідси і назва «іприт») проти англо-французьких військ. Смертельна концентрація іприту при потраплянні на шкіру 70 мг/кг. Для захисту використовують протигаз і спецодяг, а для дегазації — хлоруючі та окиснюючі агенти. /=\ /=\ Діафенілсульфон(4,4'-діамінодифенілсуль- Н2К—^. ))—8О2—4. /)—^Н2 фон). Використовується в медицині як ліїсар- кази) . Димексид(диметилсульфоксид, ДМСО) (CH3)2S+—О~. Безбарвна рідина (т. кип. 189°С). Органічний розчинник, який широко застосовують в органічному синтезі, промисловості. Використовується як лікарський препарат з протизапальними, знеболюючими і антимікробними властивостями, переважно для зовнішнього вживання (примочки, мазі, розчини тощо). Глава 29
Цистамін дигідрохлорид [ біс- (Р-аміноетил)дисуль-фід дигідрохлорид]. Використовується як лікарський препарат для профілактики променевої хвороби.
Поиск по сайту: |




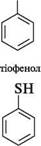
 8О3Н
8О3Н -Н,0
-Н,0 8О2С1
8О2С1 -Н2О; -НС1
-Н2О; -НС1