 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ГетерОФУнКЦІОнаЛЬнІ КарБОнОВІ КиСЛОти. ос6н5 (Жа ОСН, ОН
натрій саліцилат ОН метилсалщилат (СН3СО)2О
РОС13; СООН О О—С—СН,
ацетилсаліцилова кислота; аспірин он фенілсаліцилат; салол -С6Н5ОН ОН он оксафенамід Ацетилсаліцилова кислота, натрій саліцилат, метилсаліцилат і саліциламід застосовуються в медицині як анальгетичні, протизапальні і жарознижуючі засоби. Фенілсаліцилат використовують як антисептичний засіб при захворюваннях кишечнику. Оксафенамід виявляє жовчогінну дію.
Галова(3,4,5-тригідроксибензойна) кислота.Біла кристалічна речовина (т. пл. 220°С), добре розчиняється у воді, при нагріванні піддається декарбоксилюванню з утворенням пірогалолу, легко окиснюється на повітрі і темніє. Уперше ця кислота була виділена з французького вина, а оскільки Франція в давні часи називалася Галлією, звідси і походить назва «галова кислота». Галова кислота входить до складу дубильних речовин, що містяться в чорнильних горішках (наростах на листках деяких видів дуба, які утворюються внаслідок уколу комах — горіхотворок), дубовій корі, листках чаю і деяких інших рослин. Головною складовою частиною дубильних речовин є таніни, що являють собою глікозиди галової кислоти. Водні розчини таніну мають здатність зсідати та осаджувати білки. На цій властивості ґрунтується дубильна дія таніну, а також його застосування в медицині як кровоспинного засобу і при лікуванні опіків. Галова кислота використовується в синтезі барвників, а також для добування пірогалолу і як аналітичний реагент.
Глава 27
кумаринова кислота ортяо-кумарова кислота Кумаринова кислота у вільному стані не відома; вона існує лише у вигляді похідних (солей). При спробі виділення у вільному стані кумаринова кислота відщеплює молекулу води і перетворюється в лактон, названий кумарином:
-КаСІ -н2о
натрієва сіль кумаринової кислоти кумаринова кислота кумарин Кумарин — кристалічна речовина, що має приємний запах. Похідні кумарину дуже поширені в рослинному світі. Деякі з них використовують у медицині для профілактики і лікування тромбофлебітів (неодикумарин, фепромарон, див. c. 592). — орто-кумарова кислота — відносно стійкий у вільному стані. 27.3. ОКСОКИСЛОТИ Оксокислотами називають органічні сполуки, які містять у своєму складі карбоксильну та карбонільну (альдегідну, кетонну) групи. Для них використовують також назви «оксокарбонові кислоти», «альдегідо-і кетокислоти». Залежно від взаємного розташування функціональних груп розрізняють а-, (З-, у- та інші оксокарбонові кислоти. 27.3.1. НОМЕНКЛАТУРА як і в ряду гідроксикислот, для багатьох оксокислот широко використовують емпіричні назви (гліоксалева, піровиноградна і т. ін.). За замісниковою номенклатурою ШРАС назви оксокислот утворюють із систематичних назв карбонових кислот і префікса оксо-. Положення оксогрупи позначають за допомогою цифрових локантів.
У тривіальних назвах альдегідокислот використовують префікс форміл-, кетокислот — кето-. У разі потреби положення кетогрупи позначають літерами грецького алфавіту ос, (3, у і т. д.
ол
сн3—с—соон о
піровиноградна кислота; 2-оксопропанова кислота; а-кетопропіонова кислота
сн3— с— сн2— соон ацетооцтова кислота; 3-оксобутанова кислота; р-кетомасляна кислота о мезоксалева кислота; оксопропандіова кислота; кетомалонова кислота О щавлевооцтова кислота; оксобутандіова кислота; кетобурштинова кислота СПОСОБИ ДОБУВАННЯ Окиснення гідроксикислот.Гідроксикислоти, які містять первинну гідроксильну групу, при окисненні за м'яких умов утворюють альдегідокислоти, гідроксикислоти з вторинною гідроксигрупою — кетокислоти: о
^с—соон н гліколева кислота гшоксалева кислота
сн,—сн—соон сн,—с—соон он о молочна кислота піровиноградна кислота
Гідроліз гемінальних дигалогенокарбонових кислот.Гемінальні дигалогенокарбо-нові кислоти залежно від положення атомів галогенів (в кінці вуглецевого ланцюга або в середині) при гідролізі утворюють альдегідо- або кетокислоти: СІ
є—соон СІ дихлороцтова кислота глюксалева кислота
сн,—с—соон сі/хсі 2,2-дихлоропропанова кислота Н2О -2НС1' сн3— с— соон піровиноградна кислота ХІМІЧНІ ВЛАСТИВОСТІ Альдегідо- і кетокислоти є сильніші кислоти порівняно з відповідними карбоновими кислотами, що пов'язано з електроноакцепторним впливом карбонільної групи (-I-ефект). Реакційна здатність оксокислот зумовлена наявністю в їх структурі карбоксильної та альдегідної або кетонної груп. По карбоксильній групі вони утворюють функціональні похідні — солі, естери, аміди тощо; по карбонільній — вступають у реакції нуклеофільного приєднання, властиві альдегідам і кетонам, зокрема утворюють гідразони, оксими, ціангідрини Глава 27 і т. д. Альдегідокислоти легко окиснюються, утворюючи дикарбонові кислоти. Оксокислоти мають і низку специфічних властивостей: а- і |3-оксокислоти порівняно легко піддаються декарбоксилюванню. а- Оксокислоти в присутності концентрованої сульфатної кислоти відщеплюють карбон(IV) оксид і перетворюються в альдегід: СН3—С—СООН о піровиноградна кислота ацетальдегід Дуже легко піддаються декарбоксилюванню ^-оксокислоти. Так, ацетооцтова кислота вже при кімнатній температурі або незначному нагріванні відщеплює карбон(IV) оксид, утворюючи ацетон. Припускають, що процесу декарбоксилю-вання сприяє утворення внутрішньомолекулярного водневого зв'язку:
сн3— с— сн2— соон ацетооцтова кислота п сн3— с— сн3 о ацетон На відміну від кислот естери Р-оксокислот — досить стійкі сполуки. Важливе значення в органічному синтезі має етиловий естер ацетооцтової кислоти, який зазвичай називають ацетооцтовим естером:
У> ацетооцтовий естер За фізичними властивостями ацетооцтовий естер безбарвна рідина з приємним фруктовим запахом (т. кип. 181 °С). його добувають естеровою конденсацією етилацетату (див. конденсація Кляйзена, с. 450). 2СНз-< ^к^ < ос2н5 ос2н5 етилацетат ацетооцтовий естер Ацетооцтовий естер — таутомерна сполука. Для нього характерна кето-енольна таутомерія, зумовлена наявністю в структурі молекули СН-кислотного центру (рухливі атоми Гідрогену метиленової групи) і основного центру — атома Оксигену кетонної групи. Рухливість атомів Гідрогену метиленової групи пов'язана з елект-роноакцепторним впливом карбонільної та естерної груп за рахунок -I-ефекту:
Поиск по сайту: |

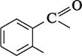

 ОН
ОН
 -сн3он
-сн3он
 о-Гідроксикорична кислота.як і інші нена-сичені карбонові кислоти з подвійним зв'язком, о-гідроксикорична кислота може існувати у вигляді двох геометричних ізомерів. цис-Ізомер називається кумариновою кислотою, а транс-ізомер — орто-кумаровою:
о-Гідроксикорична кислота.як і інші нена-сичені карбонові кислоти з подвійним зв'язком, о-гідроксикорична кислота може існувати у вигляді двох геометричних ізомерів. цис-Ізомер називається кумариновою кислотою, а транс-ізомер — орто-кумаровою:




 О
О