|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
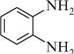
ОКРЕМІ ПРЕДСТАВНИКИ. ВИКОРИСТАННЯ. метиламінCH3—NH2
метиламінCH3—NH2. Газ з гострим запахом, що нагадує запах амоніаку, добре розчиняється у воді. Насичений водний розчин містить 35—40% метиламіну. Метиламін використовується у виробництві лікарських засобів, барвників, інсектицидів, фунгіцидів тощо. анілінC6H5NH2. Безбарвна рідина зі своєрідним запахом (т. кип. 184,4°С),
в медицині як стимулятор центральної нервової сис-
теми. о-Фенілендіамін.Безбарвна кристалічна речовина, темніє на повітрі (т. пл. 102—104°С), добре розчинний у воді. широко використовується у виробництві лікарських препаратів (дибазол і под.), барвників, пестицидів. тетраметилендіамін(путресцин) H2N—CH2—CH2—CH2—CH2—NH2. Кристалічна речовина (т. пл. 27—28°С), легко розчиняється у воді. Утворюється в процесі гниття білків при ферментативному декарбоксилюванні амінокислоти орнітину: сн2—сн2—сн2—сн—соон і і —СЛ-^з і і >ш2 ин2 >ш2 >ш2 орнітин путресцин Путресцин має неприємний запах. Він також утворюється при гнилісному розкладанні трупів, через що його відносять до групи птомаїнів (трупних отрут). В організмі людини путресцин використовується для синтезу біологічно активних поліамінів — спермідину і сперміну, які беруть участь у регуляції біосинтезу нуклеїнових кислот і білків: —(СН2)4— NN — (СН2)3— спермідин (сн2)3— ин—(сн2)4— ин—(сн2)3 спермін Глава 20 302 Г Пентаметилендіамін(кадаверин) H2N—CH2—CH2—CH2—CH2—CH2—NH2. Рідина (т. кип. 178°С), легко розчиняється у воді. Утворюється в процесі гниття білків при ферментативному декарбоксилюванні амінокислоти лізину: сн2— сн2— сн2— сн2— сн—соон 1ЧН2 кадаверин Кадаверин, як і путресцин, утворюється при гнилісному розкладанні трупів і належить до групи птомаїнів.
Бензогексоній([1,6-біс-(N-три-метиламоній)-гександибензенсуль-
2C65HSO—3 фонат], або ІчГ,ІЧ'-гексаметил-1,6-гексаметилендіамоній дибензенсуль-фонат). Біла кристалічна речовина (т. пл. 196—202°С), легко розчиняється у воді. Використовується в медицині як гангліоблокуючий і гіпотензивний засіб. Глава 21 ДІАЗО- ТА АЗОСПОЛУКИ ДІАЗОСПОЛУКИ Діазосполуками називають органічні сполуки, які містять у своїй структурі угруповання з двох атомів Нітрогену, зв 'язане з вуглеводневим радикалом і залишком мінеральної кислоти. Загальна формула діазосполук КІчГ2Х, де R — вуглеводневий радикал; X — залишок мінеральноїкислоти (СГ, Вг , N0^, Н8О4, ОН , СІЧ , 8О3Н , 8Н тощо). Залежно від природи вуглеводневого радикала розрізняють аліфатичні та ароматичні діазосполуки. У цій главі розглянуто ароматичні діазосполуки, що мають велике практичне значення в синтезі барвників, лікарських препаратів, у фармацевтичному аналізі і т. д. Загальна формула ароматичних діазосполук Аг—І^Х. Залежно від природи кислотного залишку (аніона) зв'язок між Ar—N2 і X може бути іонним або ковалентним. якщо X — залишок сильної мінеральної кислоти (СГ, Вг , Н8О4, N0^ тощо), то діазосполуки мають іонну будову і їх називають солями діазонію Ar—N+3NX~. якщо ж X — залишок слабкої мінеральної кислоти (СІчГ, Н8О^, ОН , 8Н і под.), діазосполуки мають ковалентну будову Ar—N=N—X. Діазосполуки загальної формули Ar—N=N—О М+, де M — метал, отримали назву «діазотати». У розчині зазначені форми діазосполук, залежно від pН середовища, можуть перетворюватися одна в одну. У кислому середовищі діазосполуки існують у формі солей діазонію, у середовищі, близькому до нейтрального, мають ковалентну будову, а в лужному середовищі знаходяться у формі діазотатів. Так, при дії на сіль діазонію водним розчином натрій гідроксиду в нейтральному середовищі утворюється діазосполука ковалентної будови (діазогідроксид), яка у лужному середовищі перетворюється в діазотат. І навпаки, під дією хлоридної кислоти діазотат у нейтральному середовищі переходить у діазогідроксид, а в кислому середовищі утворює сіль діазонію: кисле середовище нейтральне середовище лужне середовище Аг — N=N01" сіль діазонію арилдіазогідроксид натрій арилдіазотат
Поиск по сайту: |
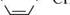 н/ 2 CH CH3 на речовина, малорозчинна у воді. Використовується
н/ 2 CH CH3 на речовина, малорозчинна у воді. Використовується