 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Бутандіамін; тетраметилендіамін
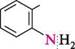
і\гн2 О-фенілендіамін СПОСОБИ ДОБУВАННЯ Діаміни добувають аналогічно моноамінам, використовуючи як вихідні речовини відповідні біфункціональні похідні. амоноліз дигалогеналканів(див. с. 282): Вг—СН2—СН2—Вг Диброметан 4ІЧН3 —СН2— СН2— Етандіамін 2ІЧН4Вг
Глава 20 Відновлення динітрилів(див. с.283): адиподинітрил —сн2— (сн2)4— сн2— гексаметилендіамін Відновлення нітроанілінів або динітробензенів(див. с. 274):
N11,
-2Н2О
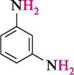
о-фенілендіамін б
.и-динітробензен л-фенілендіамін ХІМІЧНІ ВЛАСТИВОСТІ За хімічними властивостями діаміни подібні до моноамінів. Особливістю їх хімічної поведінки є лише те, що реакції можуть проходити по одній або двох аміногрупах. Так, діаміни утворюють солі з одним або двома еквівалентами кислот; за участі однієї або двох аміногруп вони вступають у реакції алкілювання, ацилювання тощо. Діаміни сильніші основи, ніж моноаміни, що пояснюється присутністю двох аміногруп. Для деяких діамінів характерні специфічні реакції, пов'язані з утворенням гетероциклічних структур. При нагріванні хлороводневих солей тетраметиленді-аміну і пентаметилендіаміну відбувається їх внутрішньомолекулярна циклізація і утворюються відповідно п'яти- і шестичленні гетероциклічні сполуки — піролі-дин і піперидин:
сн2—сн2 сн2—сн2 тетраметилендіамін дигідрохлорид; тетраметилендіамоній дихлорид піролідин гідрохлорид; піролідиній хлорид
СН2— СН2— сн2— сн2— пентаметилендіамш дигідрохлорид; пентаметилендіамоній дихлорид
Г—Н-НС1 + сн2—сн2 піперидин гідрохлорид; піперидиній хлорид
Хлороводнева сіль етилендіаміну в цих умовах вступає в реакцію міжмолекулярної циклізації, утворюючи гетероцикл — піперазин: Н /н3сг -сін3кч ^ І 2 + І 2 -^ 'і І 2-2НС1 + 2КН4С1 \+ _ +/ ^ н піперазин дигідрохлорид о-Фенілендіамін вступає в реакції конденсації з а-діальдегідами, дикетонами, альдегідо- і кетокислотами, а також карбоновими кислотами, утворюючи гетероциклічні продукти. Так, при конденсації о-фенілендіаміну з гліоксалем утворюється хіноксалін:
о-фенілендіамін гліоксаль хіноксалін У процесі конденсації з карбоновими кислотами утворюються похідні бенз-імідазолу:
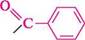
КІН НО: н......... ; А о-фенілендіамін 2-метилбензімідазол ІДЕНТИФІКАЦІЯ АМІНІВ ХІМІЧНІ МЕТОДИ Первинні аліфатичні та ароматичні аміни можна виявити за допомогою ізо-нітрильної реакції (див. с. 288) за характерним неприємним запахом ізонітрилів, які утворюються:
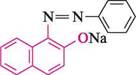
К—А=( ізонітрил Для виявлення первинних ароматичних амінів використовують реакцію діа-зотування (див. с. 304) з подальшою конденсацією солі діазонію, яка утворилася, Глава 20 з |3-нафтолом (див. реакцію азосполучення, с. 309). Спостерігають появу оранжево-червоного кольору азобарвника:
+ НС1 (надлидг) ; -Н2О бензендіазоній хлорид
р-нафтол ОН -Н2О
азобарвник; натрій 1-(бензеназо)-2-нафтолят Первинні, вторинні і третинні аміни аліфатичного та ароматичного рядів можна відрізнити один від одного реакцією з нітритною кислотою (див. с. 287 і 293). Ідентифікацію первинних і вторинних амінів часто здійснюють через утворення N-ацильних похідних. Причому для характеристики аліфатичних амінів звичайно одержують N-бензоїльні похідні, для ароматичних — N-ацетильні. Бензоїльні похідні легко утворюються при обробці амінів бензоїлхлоридом, а ацетильні — дією оцтового ангідриду:
СІ бензоїлхлорид
етиламід бензойної кислоти + НС1
сн3 ^ о оцтовий ангідрид ацетанілід ОН N-Ацильні похідні амінів — це кристалічні речовини з чіткими температурами плавлення. ФІЗИЧНІ МЕТОДИ У ІЧ-спектрах амінів спостерігаються смуги поглинання, зумовлені валентними коливаннями зв'язку C—N. В аліфатичних амінах Ус_м виявляються в ділянці 1230—1030 см~:, в ароматичних — 1300—1250 см~:. ІЧ-Спектри первинних і вторинних амінів мають смуги поглинання в ділянці 3550—3320 см~:, які відповідають валентним коливанням зв'язку N—H. У первинних амінів у цій ділянці дві смуги поглинання, а у вторинних — одна. Утворення міжмолекулярних водневих зв'язків призводить до зміщення смуг поглинання зв'язку N—H в ділянку 3330—3000 см"1. Метод УФ-спектроскопії застосовується в основному для ідентифікації арил-амінів. Аліфатичні аміни поглинають УФ-випромінювання в далекій ультрафіоле- амІни товій ділянці, яка малодоступна для вимірювання. Наявність у молекулі ариламіну аміногрупи, зв'язаної з бензеновим ядром, призводить до значного зміщення смуги бензенового поглинання в довгохвильову ділянку і збільшення її інтенсивності. Так, в УФ-спектрі аніліну бензенова смуга виявляється при Хтах = 280 нм (є = 1430). У ПМР-спектрах первинних і вторинних амінів спостерігається широкий нерозщеплений сигнал в зоні 0,5—4,7 млн"1, що відповідає протонам груп —NH2 і NH.
Поиск по сайту: |
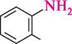
 1 якщо аміногрупи розміщені на кінцях нерозгалуженого ланцюга, то в назві вказують кількість метиленових груп (використовуючи грецькі числівники), додаючи суфікс -діамін.
1 якщо аміногрупи розміщені на кінцях нерозгалуженого ланцюга, то в назві вказують кількість метиленових груп (використовуючи грецькі числівники), додаючи суфікс -діамін. NН,
NН,
 -4Н2О
-4Н2О
 амІни
амІни
 + І----------- к Н ^ + 2Н2
+ І----------- к Н ^ + 2Н2
 \-СН3 ---► І і | ^С-СНз
\-СН3 ---► І і | ^С-СНз


 с2н5—
с2н5—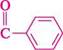
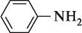
 сн3—
сн3—