 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ІЗОмерІя ОрГанІЧних СПОЛУК. ПрОСтОрОВа БУДОВа мОЛеКУЛ
Віссю симетрії називають уявну вісь, що проходить через молекулу, при повороті навколо якої на кут 360°/n (п — ціле число, рівне 2, 3, 4 і т. д.) молекула суміщається зі своїм вихідним положенням. Число п визначає порядок осі симетрії. якщо n = 2, 3 і так далі, вісь симетрії називають відповідно віссю другого, третього і так далі порядку. Наприклад, молекула хлороформу (рис. 5.4, в) суміщається зі своїм вихідним положенням при кожному повороті навколо зв'язку С—Н на кут 360°/3 = 120°. Отже вісь, що проходить через молекулу вздовж зв'язку С—Н, називається віссю симетрії третього порядку. Різні об'єкти, у тому числі і молекули, в яких відсутні площина, центр та вісь симетрії, мають властивість не суміщатися зі своїм дзеркальним зображенням. Цю властивість називають хіральністю (від грец. %єір — рука), а молекули, які її мають, — хіральними.
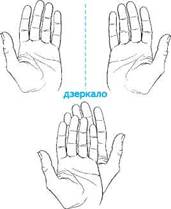
Термін «хіральність» був уведений англійським фізиком У. Томпсоном (1884). Наочним прикладом хіральності можуть слугувати ліва і права руки, які є віддзеркаленням одна одної, але разом з тим їх не можна сумістити при будь-якому способі накладення (рис. 5.5). Через це рукавичка з лівої руки не придатна для правої і навпаки. Молекули, що мають хоча б один елемент симетрії, завжди ідентичні зі своїм дзеркальним відображенням, і їх називають ахіральними.
Хіральність молекули можна легко встановити шляхом побудови моделі молекули і моделі її дзеркального відображення з подальшим їх суміщенням. якщо моделі не суміщаються — молекула хіральна, якщо суміщаються — ахіральна. Такий же висновок можна зробити і на підставі стереохімічних формул молекул за наявності або відсутності елементів симетрії, найчастіше площини симетрії: СІ хіральні молекули І (площина симетрії Вг^ \,"'Н и г-
відсутня) І3 бромойо д охлор ом етан
ахіральні молекули
(площина симетрії присутня) хлороформ Хіральність молекул — обов'язкова умова для виявлення речовиною оптичної активності. Сполуки з одним асиметричним атомом Карбону.Однією з причин виникнення хіральності органічних молекул є наявність в їх структурі sр3 -гібридизованого атома Карбону, зв'язаного з чотирма різними замісниками. Такий атом Карбону називають хіральним, або асиметричним. Часто для нього застосовують більш загальну Глава 5 назву — «хіральний центр». У структурних формулах асиметричний атом Карбону прийнято позначати зірочкою — С*: Н Н
д С сі
2-хлоробутан Молекули, які містять один асиметричний атом Карбону, існують у вигляді двох ізомерів, що відносяться один до одного як хіральний предмет до свого дзеркального відображення. Такі ізомери називають енантіомерами (від грец. enantio — протилежний) (рис. 5.6).
Н дзеркало А б в Рис. 5.6. Моделі енантіомерних молекул бромойодохлорометану Дзеркальне відображення хіральної молекули утвориться, якщо поміняти місцями будь-які два замісники при асиметричному атомі Карбону. енантіомери дуже подібні між собою, але все ж таки не тотожні. Вони мають однаковий склад і послідовність зв'язування атомів у молекулі, але відрізняються відносним розташуванням їх у просторі, тобто конфігурацією. якщо в ізомері а перехід від атома йоду до атома Хлору через атом Брому спрямований за годинниковою стрілкою, то в ізомері б аналогічний перехід має протилежний напрям (див. рис. 5.6). У тому, що ці молекули різні, можна легко переконатися при накладенні їх моделей одна на одну (див. рис. 5.6, в). енантіомери ідентичні за фізичними і хімічними властивостями. Суттєва відмінність між ними полягає в тому, що вони по-різному відносяться до поляризованого світла, а саме: обертають площину поляризації на той самий кут, але в протилежних напрямах (якщо один обертає вліво, то інший — на такий же кут вправо). Тому їх ще називають оптичними ізомерами, або оптичними антиподами. Крім того, енантіомери з різною швидкістю реагують з іншими хіральними сполуками і, як правило, мають різну фізіологічну активність. Суміш рівних кількостей енантіомерів називають рацемічною. Така суміш не має оптичної активності, тому що однакове за значенням, але протилежне за напрямом обертання взаємно компенсується. Для позначення рацемічної суміші перед назвою сполуки ставлять символ (±). Зображення оптичних ізомерів на площині.Для зображення просторової будови оптичних ізомерів на площині можуть бути використані стереохімічні формули. Наприклад, енантіомери 2-бутанолу, зображені за допомогою стереохімічних формул, мають такий вигляд: сн3 сн, С2Н5" он но
Поиск по сайту: |
 Ні
Ні

 Вг
Вг