 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ОСНОВНІ ХАРАКТЕРИСТИКИ КОВАЛЕНТНОГО ЗВ'ЯЗКУ
Довжина зв'язку. Довжиною зв'язку називають відстань між центрами зв'язаних у молекулі атомів. Для визначення довжини зв'язку застосовують дифракцію рентгенівських променів, дифракцію електронів і спектроскопічні методи. Оскільки атоми в молекулі знаходяться в постійному коливальному русі, довжини зв'язків є наближеними величинами. У табл. 3.2 наведені довжини найбільш розповсюджених ковалентних зв'язків. У хімічній літературі довжини зв'язків звичайно наводяться в ангстремах (А) або нанометрах (нм). У міжнародній системі одиниць (СІ) як одиницю вимірювання Глава 3 Таблиця 3.2 Довжини хімічних зв'язків
довжини зв'язку застосовують пікометри, скорочено пм (1 нм = 10 А = 1000 пм). як видно з наведених даних (табл. 3.2), довжина зв'язку залежить від природи і типу гібридизації атомів, які утворюють зв'язок. Чим більший s-характер атомів Карбону, тим міцніший зв'язок між ними. Найчастіше це пояснюють збільшенням s-характеру гібридної орбіталі і збільшенням площі перекривання орбіталей. енергія зв'язку. Енергією зв'язку називають енергію, яка виділяється при утворенні хімічного зв 'язку між двома вільними атомами, або ж енергію, яку необхідно затратити на роз 'єднання двох зв 'язаних атомів. Утворення зв'язку завжди супроводжується виділенням, а його розрив — витратою певної кількості енергії. Енергія, необхідна для гомолітичного (А-|-В) розщеплення окремого зв'язку в молекулі, називається енергією дисоціаціїзв'язку. Оскільки енергія дисоціації залежить від структури молекули, для характеристики енергії зв'язку звичайно використовують середні значення енергії дисоціації. енергію зв'яз- Таблиця 3.3
' Значення Е приведені при t = 25 °C. ХІмІЧниЙ ЗВ'яЗОК ку виражають у кілоджоулях на моль (кДж/моль) або в кілокалоріях на моль (ккал/моль). Значення енергії зв'язку служить мірою її міцності. У табл. 3.3 наведені значення енергії зв'язків, найбільш розповсюджених в органічних сполуках. При порівнянні даних табл. 3.2 і 3.3 видно, що зі збільшенням s-характеру зв'язку його довжина зменшується, а міцність зростає. Подвійні зв'язки коротші і міцніші за відповідні одинарні, а потрійні — за подвійні. Але разом з тим енергія подвійного зв'язку менша за подвоєну, а потрійного — за потроєну енергію одинарного зв'язку. це означає, що с-зв'язок міцніший за я-зв'язок. Проаналізувавши елементи в межах групи Періодичної системи (наприклад, зв'язок C—H), можна побачити, що при русі зверху вниз довжина зв'язку збільшується, а міцність — зменшується. Полярність зв'язку. Полярністю зв'язку називають нерівномірний розподіл електронної густини зв 'язку, обумовлений різною електронегативністю атомів. Електронегативність — це здатність атома притягувати електрони. Вона залежить від ефективного заряду ядра атома і виду гібридизації атомних орбіталей. Найбільш відому шкалу електронегативності склав американський хімік лайнус Карл Полінг (табл. 3.4). Таблиця 3.4 Електронегативність елементів за шкалою Полінга
Згідно з даними табл. 3.4 електронегативність атома Карбону зростає при переході від sp3- до sp-гібридного стану, що пояснюється збільшенням s-характеру орбіталей. Полярний ковалентний зв'язок утворюється між атомами з різною електронегативністю, а також між атомами з однаковою електронегативністю, але які, у свою чергу, пов'язані з атомами, що мають іншу електронегативність (див. розд. 4.1):
d- -СІ хлорометан 8 + сн3-»-сн2-»-сі хлоретан У молекулі хлоретану атом Хлору поляризує не тільки зв'язок С—Сl, але і зв'язок С—С. Кількісно полярність зв'язку виражається значенням дипольного моменту, який позначають буквою [і (грец. «мю»). Дипольний момент дорівнює добутку відстані між «центрами ваги» позитивних і негативних зарядів на їх значення. Зазвичай дипольний момент молекул виражають в одиницях Де-бая (Db). В одиницях СІ його виражають в аттокулоннанометрах (аК•нм). ШЬ = 3,33564• 1СГ3 аК-нм. Дипольний момент — векторна величина. Для більшості ковалентних зв'язків дипольний момент дорівнює 0—3 Db, сильнополярні зв'язки мають 4—7Db, іонні — понад 10 Db. Молекулу, що складається з трьох і більше атомів, розглядають як систему кількох диполів. Виміряти дипольний момент кожного окремого зв'язку в такій молекулі неможливо. Можна виміряти тільки сумарний дипольний момент молекули (результуючий диполь), що являє собою Глава 3
мадський діяч. Головне наукове досягнення — учення про хімічний зв'язок (1931—1934). Розробив метод напрямлених валентних зв'язків, уявлення про гібридизацію і перекривання атомних орбіталей, концепцію електронегативності атомів і частково-іонного характеру зв'язку. Його монографія «Природа хімічного зв'язку» (1939) — шедевр хімічної літератури. Створив (1931—1933) теорію резонансу. У галузі біохімії висловив ідею про спіральну будову поліпептидного ланцюга. Вивчав будову ДНК, антитіл, природу імунологічних реакцій. Двічі суму векторів дипольних моментів окремих зв'язків. Знаючи дипольний момент молекули і значення кутів між напрямком зв'язків, можна визначити дипольні моменти окремих зв'язків шляхом розкладання за правилом паралелограма. Сумарний дипольний момент молекули залежить не тільки від кількості та природи полярних зв'язків, але і від взаємного розташування їх у просторі. Наприклад, молекула тетрахлорометану ССl4 містить чотири зв'язки C—Cl з дипольним моментом 1,46 Db кожний, а в цілому сполука не має диполя ([і = 0), тому що відбувається взаємна компенсація дипольних моментів окремих зв'язків. Молекула ж хлорометану СН3—Сl в основному полярністю зв'язку С—Сl. Наявність диполя суттєво впливає на фізичні і хімічні властивості речовини. Температури кипіння полярних сполук вищі, ніж неполярних. Полярні речовини добре розчиняються в полярних розчинниках, а неполярні, як правило,— у неполярних. Полярність хімічних зв'язків визначає тип хімічної взаємодії (тип реакції) і є кількісною характеристикою реакційної здатності речовини. Поляризованість зв'язку.Під «поляризова-ністю» розуміють легкість, з якою зміщуються хІмІЧниЙ ЗВ'яЗОК напрямленість зв'язків.Ковалентні зв'язки мають певну напрямленість у просторі. електронні пари, які утворюють хімічні зв'язки, прагнуть зайняти таке просторове положення одна відносно одної, щоб сили електростатичного відштовхування між ними були мінімальними. Кути між напрямами зв'язків у молекулі називають валентними кутами.Значення валентного кута залежить від стану гібридизації атомних орбіталей і природи атомів, що утворюють зв'язки. Так, кути між зв'язками С—Н у метані складають 109° 28'. Однак це справедливо тільки в тих випадках, коли атом Карбону зв'язаний з чотирма однаковими замісниками. Здебільшого спостерігаються невеликі відхилення від кута правильного тетраедра. Наприклад, у молекулі 2-бромопропану валентний кут С—С—Вr дорівнює 114° 2'. Аналогічно незначне відхилення від валентних кутів 120° і 180° спостерігається в сполуках з атомом Карбону в sр2- і sр-гібридизації. Глава 4
Ідея про взаємний вплив атомів на реакційну здатність органічних сполук була вперше висловлена Олександром Михайловичем Бутлеровим у теорії хімічної будови. Подальшого розвитку вона набула в теорії електронних зміщень (електронних ефектів). За сучасними уявленнями, реакційна здатність органічних сполук визначається характером розподілу електронної густини в молекулі та рухливістю (поляризованістю) електронів ковалентних зв'язків. В органічних сполуках розрізняють два види електронних зміщень: зміщення електронної густини вздовж ланцюга с-зв'язків — індуктивний ефект; зміщення по системі я-зв'язків — мезомерний ефект. ІНДУКТИВНИЙ ЕФЕКТ як уже зазначалося, при утворенні ковалентного зв'язку між двома атомами з однакової електронегативністю електронна пара рівною мірою належить зв'язаним атомам (неполярний зв'язок). якщо ж атоми мають різну електронегативність, електронна густина ковалентного зв'язку зміщується до більш електронегативного атома (полярний зв'язок). У складних органічних молекулах полярний ковалентний зв'язок впливає на сусідні зв'язки, викликаючи їх поляризацію: 6'"+ 6"+ d'+ d+ d- сн3—сн2—сн2—сн3 сн3->-сн2->-сн2->-сн2->-сі бутан, (1 = 0 1-хлоробутан, (і = 0 У молекулі бутану вуглець-вуглецеві зв'язки неполярні, електронна густина розподілена симетрично, і молекула не має дипольного моменту. Уведення в молекулу бутану атома Хлору (1-хлоробутан) приводить до поляризації не тільки зв'язку С—Сl, але і сусідніх вуглець-вуглецевих зв'язків. Атом Хлору, маючи більшу електронегативність, ніж атом Карбону, відтягує електрони с-зв'язку C—Сl у свій бік. У результаті такого зміщення на атомі Хлору виникає частковий негативний заряд (5-), а на атомі Карбону — рівний за значенням частковий позитивний заряд (5+). Зменшення електронної густини на С-1 частково компенсується відтягуванням у його бік електронної густини із сусіднього атома Карбону, що приводить до поляризації зв'язку С-2—С-1 і виникнення часткового позитивного заряду на атомі С-2. Той, у свою чергу, спричиняє поляризацію зв'язку С-3—С-2 і т. д. У міру віддалення зв'язку частковий заряд на атомах Карбону зменшується: 5+ > 5'+ > 5"+ > 5'"+. Таким чином, поляризація зв'язку С—Сl спричиняє електронну асиметрію молекули і появлення дипольного моменту. Передачу електронного впливу замісника вздовж ланцюга о-зв'язків називають індуктивним (індукційним) ефектом (пізньолат. «inductivus» — від лат. «inductio» — наведення, спонукання). ВЗаЄмниЙ ВПЛиВ атОмІВ В ОрГанІЧних СПОЛУКах Індуктивний ефект позначають символом I, напрям зміщення електронної густини о-зв'язків — прямою стрілкою (9). Дія індуктивного ефекту найсильніше виявляється на двох найближчих о-зв'язках. Індуктивний ефект через слабку поляризованість о-зв'язків згасає через три-чотири зв'язки. Залежно від напряму електронного впливу замісника розрізняють позитивний (+І) і негативний (—І) індуктивний ефект. Для оцінки індуктивного впливу замісника за стандарт прийнято індуктивний ефект атома Гідрогену, який, з огляду на невеликий дипольний момент зв'язку С—Н, вважають рівним нулю. Замісники, що притягають до себе електрони о-зв'язку більшою мірою, ніж атом Гідрогену, виявляють негативний індуктивний ефект (-І), а замісники, що відштовхують від себе електрони о-зв'язку сильніше атома Гідрогену, виявляють позитивний індуктивний ефект (+І). Під притягуванням і відштовхуванням мається на увазі різниця в положенні електронів зв'язку, зумовлена різною електронегативністю атома Гідрогену і замісників. Замісники розташовують у ряди в порядку зменшення -І- або +І-ефектів стосовно атома Гідрогену: —I-ефект К—СН2НН; стандарт I = 0 +I-ефект
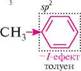
* Ar — ароматичний радикал. ** Аlk — алкільні групи. Негативний індуктивний ефект замісника, як правило, тим більший, чим вища електронегативність атома, зв'язаного з вуглецевим ланцюгом. Найбільший негативний індуктивний ефект виявляють групи, які несуть позитивний заряд. За інших рівних умов sр-гібридизовані атоми мають більшу електроноакцепторну здатність, ніж sp2-, а ті, у свою чергу,— більшу, ніж sp3-гібридизовані атоми. цим пояснюється негативний індуктивний ефект залишків ненасичених і ароматичних вуглеводнів:
■»Р" зр
2і зр' зр
Глава 4
електронодонорні властивості алкільних груп зростають при переході від первинних до третинних радикалів: СН3
Електронодонорні властивості алкільних груп У ряду первинних алкільних радикалів позитивний індуктивний ефект зростає зі збільшенням вуглецевого ланцюга:
1. Індуктивний ефект виявляється завжди при наявності в молекулі атомів 2. Індуктивний ефект поширюється тільки через с-зв'язки і завжди в одному 3. Індуктивний ефект згасає в ланцюгу через три-чотири с-зв'язки.
Поиск по сайту: |

 ВЗАЄМНИЙ ВПЛИВ АТОМІВ В ОРГАНІЧНИХ СПОЛУКАХ
ВЗАЄМНИЙ ВПЛИВ АТОМІВ В ОРГАНІЧНИХ СПОЛУКАХ
 СНСН—СН
СНСН—СН —/-ефект пропен
—/-ефект пропен НС^СН;
НС^СН; —/-ефект пропін
—/-ефект пропін Найбільший позитивний індуктивний ефект виявляють замісники, які несуть негативний заряд.
Найбільший позитивний індуктивний ефект виявляють замісники, які несуть негативний заряд.
 Таким чином, на підставі вищевикладеного можна зробити такі висновки:
Таким чином, на підставі вищевикладеного можна зробити такі висновки: