|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
КОВАЛЕНТНІ о- І я-ЗВ'ЯЗКИ. Залежно від способу перекривання атомних орбіталей розрізняють ковалентні зв'язки
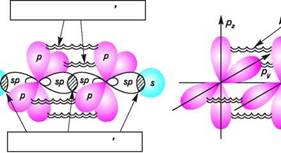
Залежно від способу перекривання атомних орбіталей розрізняють ковалентні зв'язки двох типів: о- (грец. «сигма») зв'язки і я- (грец. «пі») зв'язки. а-Зв'язком називають одинарний ковалентний зв'язок, утворений у результаті перекривання атомних орбіталей уздовж лінії, яка з 'єднує ядра двох атомів, що зв'язуються (о-перекривання) (рис 3.7). ► 4 7
_____________ >_.. Рис. 3.7. Схема перекривання атомних орбіталей при утворенні а-зв'язку: а —тип s—s; б —тип s—p; в —тип s—sр3 ; г —тип sр3 —sр3 Молекулярні орбіталі, що виникають при цьому, називаються відповідно о-МО (зв'язуюча молекулярна орбіталь) і с*-МО (антизв'язуюча молекулярна орбіталь) (див. рис. 3.3). Максимальна електронна густина при с-перекриванні знаходиться на осі, що з'єднує ядра двох атомів, які зв'язуються. У більшості органічних сполук с-зв'язки утворюються переважно за рахунок перекривання гібридних sр3-, sр2- і sр -орбіталей, які є енергетично вигіднішими і забезпечують більш ефективне перекривання (рис. 3.8). У молекулі етану о-зв'язки C—H утворюються внаслідок осьового s— sр3 -перекривання, а с-зв'язок С—C — за рахунок sр3— sр3-перекривання орбіталей. Оскільки максимальна електронна густина при о-перекриванні зосереджена в просторі між ядрами атомів, то о-зв'язок має велику міцність. Поряд з перекриванням атомних орбіталей уздовж осі, що з'єднує ядра атомів, існує так зване бокове перекривання атомних орбіталей. У ньому беруть участь тільки паралельно розташовані р-атомні орбіталі. Глава 3
5-АО атома Гідрогену ' ст-перекривання Н н Н н Рис. 3.8. Утворення а-зв'язків у молекулі етану СH3—CH3 Бокове перекриванняр-орбіталей називають п-перекриванням, а зв 'язок, що утворюєmься,— п-зв'язком (рис. 3.9).
я-орбіталь (зв'язуюча) Рис. 3.9. Схема перекривання атомних орбіталей при утворенні я-зв'язку У результаті я-перекривання двох р-атомних орбіталей утворюються дві молекулярні я-орбіталі, одна з яких називається я-зв'язуючою МО, інша — я*-анти-зв'язуючою МО. В основному стані обидва електрони займають зв'язуючу я-орбіталь, що приводить до утворення я-зв'язку. Максимальна електронна густина я-зв'язку сконцентрована у двох ділянках — вище і нижче осі, яка з'єднує ядра атомів. Тому я-зв'язок слабший, ніж с-зв'язок. я-Зв'язок утворюється лише між атомами, які знаходяться в sp2- і sр-гібридному стані (рис. 3.10). У молекулі етилену (рис. 3.10, 10.1) атоми Карбону знаходяться в sp2-гібридизації. о-Перекривання трьох гібридизованих орбіталей кожного з атомів Карбону дає вже розглянуті вище с-зв'язки (два С—Н і один С—С). я-Перекривання двох не-гібридизованихр-орбіталей дає вуглець-вуглецевий я-зв'язок. Унаслідок цього між атомами Карбону утворюється подвійний зв'язок, який являє собою поєднання о- і я-зв'язкш. При цьому я-зв'язок розташований у площині, перпендикулярній до площини с-зв'язку. Аналогічно утворюється я-зв'язок між атомами, що знаходяться в sp-гібридному стані. У молекулі ацетилену (рис. 3.11, 12.1) атоми Карбону знаходяться в sp-гібри-дизації та утворюють між собою потрійний зв'язок, що складається з одного о-і двох я-зв'язкш. с-Зв'язок виникає за рахунок перекривання sр-гібридизованих ХІмІЧниЙ ЗВ'яЗОК
тс-перекривання (я-зв'язок)
Рис. 3.11. Утворення тс-зв'язків у молекулі ацетилену HC3CH: а — атомно-орбітальна модель ацетилену; б — 7Т-зв'язки орбіталей, а чотири р-орбіталі утворюють два я-зв'язки, розташовані у взаємно перпендикулярних площинах. Залежно від кількості електронних пар, які беруть участь в утворенні хімічного зв'язку між двома атомами, розрізняють прості і кратні ковалентні зв 'язки. Прості зв'язки, їх ще називають одинарними, представлені завжди с-зв'язком. До складу кратних зв'язків поряд з с-зв'язком уходить також я-зв'язок. Розрізняють подвійні і потрійні кратні зв 'язки.
Поиск по сайту: |

 н
н
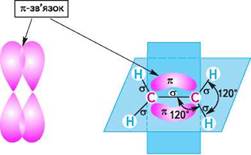

 ст-перекривання (а-зв'язок)
ст-перекривання (а-зв'язок) Рис. 3.10. Утворення 7і-зв'язку в молекулі етилену H2C=CH2: а — атомно-орбітальна модель етилену; б — я-зв'язок
Рис. 3.10. Утворення 7і-зв'язку в молекулі етилену H2C=CH2: а — атомно-орбітальна модель етилену; б — я-зв'язок