 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
СПОСОБИ ЗОБРАЖЕННЯ РОЗПОДІЛУ ЕЛЕКТРОННОЇ ГУСТИНИ В МОЛЕКУЛАХ. ПОНЯТТЯ ПРО РЕЗОНАНС
Структурні формули досить однозначно описують будову органічних сполук лише з локалізованими хімічними зв'язками, тобто коли електрони зв'язку розділені (локалізовані) між двома атомними ядрами. Зміщення електронної густини в локалізованих зв'язках молекули зображають у структурній формулі прямою стрілкою (): хлоретан У молекулах з кон'югованими системами зв'язків одна або кілька зв'язуючих орбіталей належать уже не двом атомам, а охоплюють кілька атомних ядер. Та- Глава 4 60 Г кий зв 'язок називають делокалізованим. Використовувані в структурних формулах для позначення хімічних зв'язків штрихи не відображають реального положення електронів у делокалізованих зв'язках. Для зображення розподілу електронної густини в кон 'югованій системі молекули за допомогою структурних формул застосовують два способи. Один з них полягає в тому, що сполуку зображують однією структурною формулою, в якій вигнутою стрілкою () вказують напрям зміщення р- або п-електронів:
сн3— етилацетат 4-нітроанілін Ідея другого способу належить американському вченому лайнусу Карлові Полінгу та отримала назву «метод резонансних структур». Суть його в тому, що делокалізацію електронів у кон 'югованій системі зображують за допомогою кількох структурних формул, так званих резонансних (граничних) структур, які відрізняються одна від одної лише розподілом електронних пар між ядрами атомів. Дійсна електронна будова молекули не відповідає жодній з цих структур, а є проміжною між ними, тобто реальна молекула розглядається як гібрид резонансних структур. Взаємозв'язок граничних структур зображують двосторонньою стрілкою (79—). Делокалізацію електронів у молекулі фенолу можна зобразити у вигляді таких граничних структур:
Резонансні структури не існують реально, це лише спосіб опису делокалізації електронів у молекулі. Внесок кожної структури в дійсну будову молекули пропорційний її стійкості, тобто чим стабільніша гранична структура, тим внесок її значніший. Відносна стійкість резонансних структур визначається кількома факторами. Стійкішою вважається структура, в якій: а) міститься більше ковалентних зв'язків н2с=сн—сн=сн2 <->■ н2с—сн=сн—сн2 А Б тобто структура А стабільніша, ніж структура Б; б) негативний заряд «розташований» на більш електронегативному атомі (або /? _ /° - _ /°+ Н0С—СН Сч ^ ^ Н0С СН—С\ "^ ► Н0С СН—С\ хн хн хн А Б В тобто структура А робить основний внесок, структура Б стабільніша, ніж структура В; ВЗаЄмниЙ ВПЛиВ атОмІВ В ОрГанІЧних СПОЛУКах в) менша відстань між різнойменними зарядами н2іч—сн=о <-► н2іч—сн—б <-► н2іч=сн—б А Б В тобто структура А робить основний внесок; структура Б — значний, а структура В — незначний. енергія дійсної молекули завжди нижча енергії, розрахованої для кожної з резонансних структур. Різницю між енергіями реальної молекули і найбільш стійкої граничної структури називають енергією резонансу. енергія резонансу тим вища, чим більша кількість резонансних структур і чим більша кількість низькоенергетичних структур з рівною або близькою за значенням енергією. Енергія резонансу є мірою стабілізації молекули, зумовленої делокалізацією електронів у кон'югованих системах. Незважаючи на те що метод резонансу наочніше описує делокалізацію електронної густини в кон'югованих системах, його застосування утруднене необхідністю написання великої кількості граничних структур. це особливо незручно при складанні рівнянь реакцій, тому надалі, як правило, делокалізація електронів у кон'югованих зв'язках буде зображуватися за допомогою вигнутих стрілок. Метод же резонансу застосовуватиметься лише для якісної оцінки будови і реакційної здатності окремих органічних сполук. Глава 5
Ізомерія — явище, що полягає в існуванні сполук, однакових за якісним і кількісним складом, але різних за порядком зв 'язування атомів у молекулі або розташуванням їх у просторі, унаслідок чого вони мають різні фізичні та хімічні властивості. Уперше термін «ізомери» був уведений у 1830 році шведським хіміком й. я. Берцеліусом. Теоретичне ж обґрунтування ізомерії належить російському хіміку О. М. Бутлерову. З розвитком органічної хімії поняття ізомерії розширилося завдяки уявленням про просторову будову органічних сполук (я. Вант-Гофф, Ж. А. ле Бель, 1874). Розрізняють два основних види ізомерії — структурну (ізомерія будови) і просторову (стереоізомерія).
ПРОСТОРОВА (стереоізомерія)
СТРУКТУРНА ІЗОМЕРІЯ Структурні ізомери, або ізомери будови, відрізняються один від одного послідовністю зв'язування атомів у молекулі, тобто структурою. Структурну ізомерію поділяють на ізомерію вуглецевого ланцюга, ізомерію положення, ізомерію функціональних груп. Ізомерія вуглецевого ланцюгазумовлена різною послідовністю зв'язування атомів, які утворюють вуглецевий скелет молекули: сн3—сн2—сн2—сн3 сн3—сн—сн3 (с4н10) СН3 бутан ізобутан; 2 -метилпропан Для органічних сполук циклічної будови ізомерія ланцюга може спричинятись різною величиною циклу або різним способом з'єднання циклів:
Поиск по сайту: |



 ОН ОН ОН
ОН ОН ОН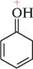
 ІЗОМЕРІЯ ОРГАНІЧНИХ СПОЛУК. ПРОСТОРОВА БУДОВА МОЛЕКУЛ
ІЗОМЕРІЯ ОРГАНІЧНИХ СПОЛУК. ПРОСТОРОВА БУДОВА МОЛЕКУЛ ІЗОМЕРІЯ
ІЗОМЕРІЯ





