 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Конформацією називають різне просторове розташування атомів або атомних груп у молекулах певної конфігурації, зумовлене обертанням навколо о-зв'язків.
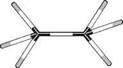
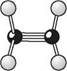
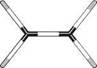
ІЗОмерІя ОрГанІЧних СПОЛУК. ПрОСтОрОВа БУДОВа мОЛеКУЛ У молекулі етану Н3С—СН3 унаслідок обертання навколо вуглець-вуглецевого зв'язку змінюється просторове розташування однієї метильної групи відносно іншої. При цьому молекула набуває численних конформацій. Органічні сполуки, які відрізняються одна від одної лише конфігурацією молекул (без урахування можливих конформацій), називають конфігураційними ізомерами. Розрізняють оптичні і геометричні конфігураційні ізомери. Стереоізомери, які мають різне просторове розташування атомів або атомних груп, зумовлене обертанням навколо простого вуглець-вуглецевого зв'язку, називають конформаційними ізомерами. 5.2.1. СПОСОБИ ЗОБРАЖЕННЯ ПРОСТОРОВОЇ БУДОВИ МОЛЕКУЛ Для зображення просторової будови органічних сполук використовують молекулярні моделі і стереоформули. молекулярні моделі. Більш наочне уявлення про просторову будову молекули дають молекулярні моделі. Зазвичай використовують три основних типи моделей — кулестрижневі, скелетні (моделі Драйдінга) і напівсферичні (моделі Стюарта— Бріглеба) (рис. 5.2).
Рис 5.2. Моделі молекул етану (зверху) і етилену (знизу): а — кулестрижневі; б — Драйдінга; в — напівсферичні (Стюарта—Бріглеба) У кулестрижневих моделях молекул атоми зображені кольоровими кульками, а хімічні зв'язки — стрижнями (рис. 5.2, а). Кульки зв'язані одна з одною стрижнями з урахуванням взаємного розташування атомів у просторі. Кулестрижневі моделі зручні для розгляду валентних кутів і обертання навколо простих зв'язків, однак вони не відтворюють відносних розмірів атомів і міжатомних відстаней у молекулі. Моделі Драйдінга, на відміну від кулестрижневих, обмежуються зображенням лише скелета молекули, тобто хімічних зв'язків між атомами (див. рис. 5.2, б), причому міжатомні відстані в цих моделях пропорційні дійсним (у масштабі 0,1 нм = 2,5 см). Напівсферичні моделі Стюарта—Бріглеба відтворюють реальні молекули з урахуванням просторового розташування атомів, міжатомних відстаней та розмірів Глава 5 66 Г атомів (див. рис. 5.2, в). У молекулах Стюарта—Бріглеба атоми зображені кольоровими, частково зрізаними кульками, радіус яких пропорційний вандерваальсовому радіусу1 атома, а відстань від центра кульки до поверхні зрізу — ковалентному радіусу2. Атом Карбону в стані sp3 -гібридизації зображують у вигляді кульки з чотирма, у sр2-------- з трьома, sр--------- з двома зрізами, атом Гідрогену представляють кулькою з одним зрізом і т. д. При складанні моделей кульки з'єднуються між собою площинами зрізів. Незважаючи на те що напівсферичні моделі найбільш вдало відтворюють реальні молекули, вони не придатні для розгляду валентних кутів між атомами і обертання навколо простих зв'язків. Стереоформули. Для зображення просторової будови органічних сполук на площині (наприклад, на аркуші паперу або дошці) користуються стереохімічними і перспективними формулами, а також проекційними формулами Ньюмена. У стереохімічних формулах хімічні зв'язки, розташовані в площині креслення, зображують звичайною рискою; зв'язки, що перебувають над площиною,— жирним клином або жирною рискою, а розташовані під площиною — штриховим клином або пунктирною лінією: Н н н н н н —с^ п н«у-~с\ н-ус~с\ Н н н н н н етан Перспективні формули відбивають просторову будову на площині з урахуванням розгляду молекули уздовж одного з вуглець-вуглецевих зв'язків. За зовнішнім виглядом вони нагадують лісопильні козли: с н с снз Н Н гі гі етан н-бутан При побудові проекційних формул Ньюмена молекулу розглядають у напрямі одного C—C-зв'язку так, щоб атоми, що утворюють цей зв'язок, затуляли один одного. З обраної пари ближній до спостерігача атом Карбону зображують точкою,
Ковалентний радіус атома рівний половині довжини ковалентного зв'язку між однаковими атомами.
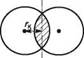
ІЗОмерІя ОрГанІЧних СПОЛУК. ПрОСтОрОВа БУДОВа мОЛеКУЛ а дальній — колом. Хімічні зв'язки ближнього атома Карбону з іншими атомами подають лініями, що беруть початок від точки в центрі кола, а дальнього — від кола:
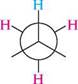
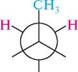
етан бутан Жодний з наведених способів зображення просторової будови не є універсальним. Стереохімічні формули частіше використовують для опису стереохімічних аспектів перебігу реакцій, перспективні формули і проекції Ньюмена — в основному для зображення конформацій молекули. Існують також проекційні формули Фішера, які застосовують зазвичай для зображення на площині просторової будови оптичних ізомерів (див. с. 71). 5.2.2. ОПТИЧНА ІЗОМЕРІЯ Оптична активність і хіральність молекул. Для характеристики оптичної ізомерії важливе значення мають поняття «оптична активність» і «хіральність» молекул. Оптичною активністю називають властивість речовини обертати площину поляризації поляризованого світла. якщо промінь звичайного світла, в якому, як відомо, електромагнітні коливання відбуваються в різних площинах, перпендикулярних до напряму його поширення, пропустити через призму Ніколя1, то вихідне світло буде площинно-поляризованим. У такому промені електромагнітні коливання відбуваються тільки в одній площині. цю площину називають площиною поляризації (рис. 5.3).
Рис. 5.3. Схема утворення поляризованого світла та обертання площини поляризації оптично активною речовиною: 1 — звичайне світло; 2 — призма Ніколя; 3 — площина поляризації; 4 — поляризоване світло; 5 — оптично активна речовина При проходженні поляризованого світла через оптично активну речовину площина поляризації повертається на певний кут а вправо або вліво (див. рис. 5.3). Якщо речовина відхиляє площину поляризації вправо (при спостереженні назустріч променю), її називають правообертаючою, якщо вліво — лівообертаючою. Праве обертання позначають знаком (+), ліве — знаком (-).
Глава 5 Кут обертання а залежить від природи оптично активної речовини, товщини шару оптично активного середовища, через яке проходить поляризоване світло, і його довжини хвилі. Для розчинів кут а залежить також від природи розчинника і концентрації оптично активної речовини. У меншій мірі оптичне обертання залежить від температури. Для порівняльної оцінки оптичної активності різних сполук використовують значення питомого обертання [а]. Питоме обертання є константою оптично активної речовини. Воно характеризує оптичну активність розчину з концентрацією оптично активної речовини 1 г/мл при товщині шару 1 дм. Питоме обертання обчислюють за однією з наведених формул:
ос 100.
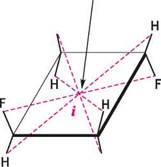
для речовин у розчині для рідких речовин де а — виміряний кут обертання, град.; / — товщина шару, дм; с — концентрація оптично активної речовини, г/100 мл розчину; р — густина рідкої речовини. Кут обертання а вимірюють за допомогою приладів, які називаються поляриметрами. Звичайно визначення проводять при температурі 20 °С і довжині хвилі D-лінії спектра натрію (589,3 нм). Відповідне значення питомого обертання позначають [ос]д . Обов 'язковою умовою для виявлення органічною сполукою оптичної активності є асиметрія (відсутність симетрії) його молекул. Оскільки молекула являє собою тривимірне утворення, її будову можна розглядати з точки зору симетрії геометричних фігур. Основними елементами симетрії є площина, центр і вісь симетрії. Площиною симетрії називають уявну площину, яка проходить через молекулу, розділяючи її на дві дзеркально рівні частини (рис. 5.4, а). Центром симетрії називають уявну всередині молекули точку, рівновіддале-ну від однакових атомів, розташованих на прямій, що проходить через цю точку (рис. 5.4, б).
Центр симетрії
Вісь симетрії 3-го порядку
н СІ СІ XI Рис. 5.4. елементи симетрії органічних молекул: а — дихлорометану; б — 1,3-дифлуор-2,4-дихлороциклобутану; в — хлороформу
Поиск по сайту: |


 1 Вандерваальсів радіус атома рівний половині відстані між двома незв'язаними атомами при їх максимальному наближенні.
1 Вандерваальсів радіус атома рівний половині відстані між двома незв'язаними атомами при їх максимальному наближенні.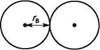
 сн3
сн3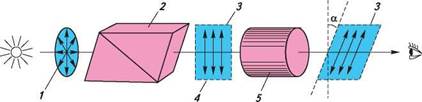
 1 Призма Ніколя — призма, виготовлена із двох кристалів ісландського шпату (СаСО3), склеєних канадським бальзамом.
1 Призма Ніколя — призма, виготовлена із двох кристалів ісландського шпату (СаСО3), склеєних канадським бальзамом.



 Площина симетрії
Площина симетрії СІ
СІ І І
І І