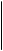|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
БУДОВА ПЕПТИДІВ І БІЛКІВ. У 1888 році харківський учений О
У 1888 році харківський учений О. Я. Данилевський зробив припущення, що внаслідок взаємодії аміно- та карбоксильних груп а-амінокислоти здатні до поліконденсації. Поліаміди, які утворюються при цьому, називають пептидами:
-сн—сош + ... + гіин—сн—соон
І. .... і»
г н,и—сн—со—ічн—сн—со—... ш-
На початку XX сторіччя німецький вчений Е. Фішер висунув поліпептидну теорію. Амідний зв'язок (—СОІЧН—) між двома а-амінокислотними фрагментами називається пептидним зв'язком. Атом Карбону пептидної групи знаходиться в 5р2-гібридизованому стані. Неподілена пара електронів атома Нітрогену вступає в спряження з л-електронами карбонільної групи, внаслідок чого подвійний зв'язок С=0 дещо подовжується (124 нм замість 121 нм у звичайного зв'язку), а зв'язок С—N скорочується (132 нм замість 147 нм) і, відповідно, набуває значною мірою характеру подвійного зв'язку, обертання навколо якого утруднене. Отже, електронна будова зумовлює жорстку площинну структуру пептидної групи.
Рис. 23.1. Розташування на площині амідної (пептидної) групи Наявність пептидного зв'язку в молекулах пептидів і білків підтверджується біуретовою реакцією: при взаємодії з лужним розчином купрум (II) сульфату з'являється фіолетове забарвлення (див. Розд. 19.5.5). 13 Органічна хімія
дзд------------------------------------------------------------------------------- Залежно від кількості амінокислотних залишків у ланцюзі пептиди поділяють на ди-, три-, тетрапептиди і т. д. Пептиди з молекулярною масою, меншою за 10 000, умовно відносять до поліпептидів, а з більшою за 10000 — до білків. Молекулярні маси білків коливаються від тисяч до мільйонів. Наприклад, окситоцин складається з 9 амінокислот, його молекулярна маса становить приблизно 1007. Молекулярні маси вірусних білків можуть досягати 50 мільйонів. Тому між білками та пептидами важко провести чітку межу. Проте білки мають складнішу структуру. Незважаючи на величезне різноманіття білків і пептидів у природі, будова їх поліпептидного (поліамідного) ланцюга однакова. Він складається з пептидних (ССЖН) і метанових (СН) груп, які чергуються. На одному кінці ланцюга знаходиться амінокислота з вільною аміногрупою (г4-кінцева амінокислота), а на іншому — амінокислота з вільною карбоксильною групою (С-кінцева амінокислота). Пептидні та білкові ланцюги прийнято записувати так, щоб ІЧ-кінцева амінокислота знаходилася зліва, а С-кінцева амінокислота — справа: Н2К—СН-гС^Й^СН-гС^№і]-СН—СООН ,__ я__ , X к' Х~ , |"__ , М-кінцева амінокислота пептилн1 зв язки С-кінцева амінокислота трипептид Назви пептидів утворюються шляхом послідовного перелічення всіх амінокислот, починаючи з ІЧ-кінцевої амінокислоти, причому назви амінокислот, крім останньої, набувають суфікса -ил (-«). Із цією ж послідовністю пишуть також скорочені позначення: Н2М—СН—СО—ЇЧН—СН—СО—гШ—СН,—СООН І І СН3 (СН2)2—СООН аланілглутамілгліцин, Ала-Глу-Глі Чітку послідовність а-амінокислот, які входять у певний полі-
Білки
білків називають просторове розташування (просторове укладення) атомів основного поліпептидного ланцюга. Вирізняють два типи вторинної структури білків — а-спіраль і складчасту ^-структуру.
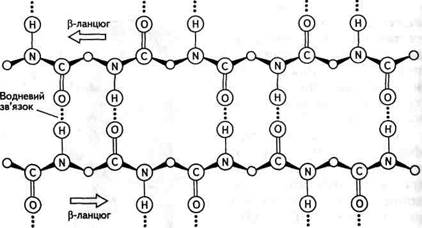
ос-Спіраль має просторову форму, подібну до правоза-кручених Гвинтових східців (рис. 23.2). Оскільки вона побудована з фрагментів, які повторюються (—ИН—Са—СО), то розміри її досить постійні. На один виток спіралі припадає приблизно 3,6 амінокислотного залишку, що відповідає лінійній відстані вздовж осі спіралі 0,54 нм. Діаметр спіралі дорівнює 0,5 нм. Крок спіралі (відстань між однаковими атомами) становить 0,15 нм. У формуванні спіральної структури головну роль виконують водневі зв'язки, що утворюються між групами С=0 та гШ, які розділені трьома амінокислотними залишками. Водневі зв'язки майже паралельні осі спіралі, а оскільки в утворенні водневого зв'язку бере участь кожна група С=0 та гШ а-спіралі, то це робить конформацію досить стійкою. Найчастіше поліпептидні ланцюги в білках спіралізуються не повністю. Наприклад, залишки проліну та оксипроліну не містять атомів Гідрогену в пептидній групі та, відповідно, не беруть участі в утворенні водневих зв'язків: поліпептидний ланцюг на цих ділянках просто зігнутий. Іншим типом вторинної структури є так звана складчаста Р-структура, в якій окремі поліпептидні ланцюги в зигзагоподібній конформації укладені паралельно і зв'язані між собою численними водневими зв'язками (рис. 23.3). Якщо поліпептидні ланцюги мають однаковий напрямок від И- до С-кінця, то утворюється паралельна складчаста р-структу- 15* Глава 23 Білки
Рис. 23.3. Схематичне зображення складчастої (3-структури ра, а якщо протилежний — антипаралельна (рис. 23.4). У (З-струк-турі бокові групи амінокислотних залишків знаходяться вище та нижче умовної площини, проведеної через структуру. Теорія розвитку Р-структури належить Л. Полінгу. Поліпептидний ланцюг, що має той чи інший тип вторинної структури, здатний певним чином скручуватись у просторі, що й визначає третинну структуру білка, тобто загальну форму полі-пептидного ланцюга. Третинна структура, крім водневих зв'язків, стабілізується іонними (між додатковими карбоксильними і аміногрупами) та ковалентними (дисульфідні містки в цистині) зв'язками, а також гідрофобною взаємодією (ван-дер-ваальсові сили тяжіння між неполярними боковими групами амінокислотних залишків). Третинна структура білків формується також під впливом водного середовища клітини, що пов'язано зі здатністю води гідрату-вати деякі гідрофільні бокові групи амінокислотних залишків і зміщувати всередину білкової молекули гідрофобні групи. Четвертинна структура білка властива макромолекулам, до складу яких входять декілька поліпептидних ланцюгів (субодиниць), сполучених між собою нековалентними зв'язками. Для виявлення пептидом специфічних функцій в організмі необхідно відтворити лише його первинну структуру, а у випадку білка — відтворити всі його конформаційні особливості (див. форзац II, рис. 1). Окреме місце в розвитку хімії білків посідає визначення полі-пептидної структури гормонів — вазопресину, окситоцинута інсуліну.
Укінець <о=с;* ...о=сЯ Кус>~Н Кус>-Н- н /С=0. Н* ^С=0- -^є£------- ^- КЧС>-Н- Кус>-Н-;
X; н*" ^с=о..н# ;с=о-е^-— <0=С ..0=С КУС^-Н- Ку >-Н н*' /С=о.. н*- ;с=о- '0=С к#.о=С к кус>м-н- к<с>-н- **' \ Н*4' ^С=0. Н* "С=0« М г
С-кінець
С-кінець >Ч- \: кус;м-н-о=с^с>р н**' ^с=о-н-і^ "*н\ х=о^ -^--------------- -&-
кус>-н-о=схс>р ьК >=0...н-м/ "*н\
іе
н** "^с=о-н-м^ **н\
Єг- К Р
ку„;м-н-о=с К/ ^с=о-н-м^ **н\
І^І-кінець Фен-|-Тйр— Цис—СООН Глава 23 При цьому окситоцин спричиняє скорочення непосмугованих м'язів, зокрема, матки, а вазопресин підтримує баланс рідини в організмі. Десять років (1943—1953) знадобилося англійському біохімікові Ф. Сенгеру для розшифрування структури гормону підшлункової залози — інсуліну. Він встановив, що молекула інсуліну складається з двох поліпептидних ланцюгів, сполучених між собою дисульфід-ними містками: А-ланцюг містить 21 амінокислотний залишок і додатковий дисульфідний зв'язок, завдяки якому інсулін у просторі утворює петлю, а Б-ланцюг — ЗО залишків (рис. 23.5). Білки
Поиск по сайту: |

 Глава 23
Глава 23 Вторинною структурою і 0.5 нм
Вторинною структурою і 0.5 нм