 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
О КОНТРОЛЬНІ ПИТАННЯ І ВПРАВИ
1. Дайте визначення понять: «вуглеводи», «моносахариди», «альдози», «кетози», «альдопентози», «кетогексози». Наведіть приклади сполук і назвіть їх. 2. Напишіть структурні формули таких сполук: а) а-2)-глюкопіранози; ґ) альдотетрози; б) р-2)-глюкофуранози; д) кетотетрози; в) а-.£>-фруктопіранози; є) альдопентози; г) 3-і)-галактопіранози; є) гліцеринового альдегіду.
424-----------------------------------------------------------------
3. Назвіть наведені сполуки і класифікуйте їх:
н-но-но- н- СН2ОН
СН2ОН
СН2ОН
ОСН, є) Н2С—СН—СНО
І І ОН ОН н н он н
є) Н2С—СН—С—СН2ОН ж) Н2С—СН—СН—СН- 4. До якого стереохімічного ряду (В- чи Ь-) належить кожен з наведених моносахаридів: сн2он
в, V0 -он
но-н-н-
Вуглеводи 8. Які з наведених діастереомерів є епімерами?
а) С б) С в) С г) С
-он -он -он
СН2ОН 9. Напишіть перспективні формули Р-Д-)-фруктопіранози та Р-Д-)-фруктофуранози. 10. Напишіть проекційні формули /)-,£-форм глюкози, фруктози, ма-нози, галактози. 11. Яке явище називають мутаротацією? Наведіть схеми цикло-оксо-та-утомерних перетворень: а) 2)-глюкози; б) І)-фруктози; в) Д-рибози. 12. Якими перетвореннями доведено будову глюкози? 13. Які вуглеводи мають назву «дисахариди»? Що таке глікозидний зв'язок? Напишіть схему гідролізу сахарози. 14. Які з наведених дисахаридів реагуватимуть з реактивом Толленса? Назвіть манози, які утворюються під час гідролізу цукрів: а) мальтози; б) лактози; в) целобіози; г) сахарози.
СН2ОН ? ?-еритроза ?-ксилоза ?-фрукгоза 5. Скільки хіральних центрів містять молекули альдопентози, кетогек-сози? Розрахуйте, скільки просторових ізомерів можуть мати ці сполуки. 6. Напишіть фуранозні і піранозні циклічні формули /)-глюкози. Яка форма більш стійка і чому? Який атом Карбону називають ано-мерним? 7. Глюкоза, фруктоза і маноза є епімерами. У чому подібність і відмінність будови їх молекул? Напишіть структурні формули І)-(+)-глю-кози, /)-(-)-фруктози та /)-(+)-манози.
Білки
Білки — основа всього живого. Вони є компонентами всіх клітин і тканин живих організмів. До білкових речовин належать ферменти, деякі гормони тощо. Поряд з нуклеїновими кислотами білки являють собою найскладніші зі створених природою біопо-лімерів. Молекулярна маса білків становить від 5000 до кількох мільйонів. Білки з низькою молекулярною масою називаються пептидами. Залежно від структури білки поділяють на прості {протеїни) та складні {протеїди). Останні, крім білка, містять у своїй структурі хімічно зв'язану з ним простетичну групу — небілкову частину молекули. За природою простетичної групи протеїди поділяють на ліпопротеїди, нуклеопротеїди, глікопротеїди, хромопротеїди, фосфопротеїди та металопротеїди. Ліпопротеїди як простетична група містять ліпіди, нуклеопротеїди — нуклеїнові кислоти, глікопротеїди — вуглеводи, хромопротеїди — пігменти, фосфопротеїди — фосфатну кислоту, металопротеїди — метали. Існують також складні білкові комплекси, до складу яких водночас входять білки, ліпіди та вуглеводи, — так звані гліколіпо-проте'іди. Вони містяться, наприклад, у сполучній тканині, клітинних стінках бактерій та ін. Залежно від просторової форми молекул білки поділяють на глобулярні та фібршіярні. Глобулярні білки мають сферичну або еліпсоїдну форму, фібршіярні — складаються з витягнутих ниткоподібних макромолекул, які називають протеїноїдами. Глобулярні білки (альбумін, глобулін) малостійкі до дії температур, кислот і лугів, а фібршіярні (білки волосся, нігтів, епідермісу; сполучної, кісткової, хрящової тканин тощо) дуже стійкі. Мономерними одиницями білків і пептидів є а-амінокислоти. До складу більшості білків входить близько 25 різних а-амі-нокислот загальної формули К—(N112)011—СООН,з яких приблизно 20 присутні в кожній білковій молекулі. Основні а-амі-нокислоти, що входять до складу білків, подано в табл. 23.1. У номенклатурі а-амінокислот здебільшого застосовують тривіальні назви: гліцин, аланін, валін, лейцин та ін. У біохімії вдаються також до трилітерного скорочення тривіальних назв, наприклад: гліцин — Глі, аланін — Ала, валін — Вал. Систематичні назви для природних а-амінокислот практично не застосовують. За хімічною природою залишку, зв'язаного з сс-амінокислот-ним фрагментом СН(МН2)СООН, а-амінокислоти поділяють на аліфатичні, ароматичні та гетероциклічні.
Залежно від кількості груп —МН2 та —СООН у молекулі розрізняють а-амінокислоти: моноаміномонокарбонові (гліцин, валін та ін.), моноамінодикарбонові (аспарагінова, глутамінова кислоти та їх аміди) і діаміномонокарбонові (орнітин, лізин, аргінін, гістидин). За кислотно-основними властивостями а-амінокислоти поділяють на нейтральні (містять рівну кількість аміно- та карбоксильних груп), кислі (з додатковою карбоксильною групою) та основні (з додатковою аміногрупою). Більшість а-амінокислот утворюється в організмі (замінні амінокислоти), але деякі а-амінокислоти організм людини нездатний синтезувати; вони надходять у складі білків, які вводяться в організм з їжею (незамінні амінокислоти) (табл. 23.1).
? ьт2 (СНз)2СНСН2—СН—СООН ИНз СН3СН2СН—СН—СООН СН3 N4, носн2—сн—соон NН2 сн3сн—сн—соон ОН N42 нооссн2—сн—соон мн2 нооссн2сн2—сн—соон ІЧНз Н2К(СН2)з—СН—СООН ? іт2 Н2N(СН2)4—СН—СООН N42 ^N(^(№2)3—СН—СООН
'? NН Н^ССН2—СН—СООН О N4, Гліцин, глікокол,амінооц-това кислота Аланін, а-амінопропіонова кислота Валін*, а-аміноізовалеріа-нова кислота Лейцин*,ос-аміноізокапро-нова кислота Ізолейцин*,а-аміно- Р-метилвалеріанова кислота Серин, а-аміно-р-гідрокси-пропіонова кислота Треонін*,сс-аміно-Р-гідроксимасляна кислота Аспарагінова кислота, амінобурштинова кислота Глутамінова кислота, а-аміноглутарова кислота Орнітин,сс,5-діаміно-валеріанова кислота Лізин*, а, є-діамінокапро-нова кислота Аргінін,а-аміно-8-гуаніди-новалеріанова кислота Аспарагін,Р-амід аспарагінової кислоти Глава 23 Таблиця 23.1 Трилітерне позначення Глі Ала Вал Лей Іле Сер Тре Асп Глу Орн Ліз Арг Асн
* Незамінні амінокислоти.
СТЕРЕОІЗОМЕРІЯ Усі а-амінокислоти, за винятком гліцину, містять хіральний сс-карбоновий атом та існують у вигляді пари енантіомерів. Для позначення конфігурацій при хіральному центрі застосовують Д£-систему:
НООС
Н2г>[-
і)-а-амінокислота а-Амінокислоти, що входять до складу білків тварин і людини, мають ^-конфігурацію. Амінокислоти .0-ряду зустрічаються лише в небілкових компонентах рослин і грибів, а також синтезуються мікроорганізмами. Використання а-амінокислот Х-ряду для біосинтезу білків має дуже важливе значення у формуванні їхньої просторової структури та виявленні біологічної активності. ФІЗИЧНІ ВЛАСТИВОСТІ ос-Амінокислоти являють собою кристалічні речовини, що не мають чітких температур плавлення і розкладаються при температурі вище 200 °С. Вони нерозчинні в неполярних органічних розчинниках, але розчинні у воді. У кристалічному стані та водних розчинах амінокислоти знаходяться у вигляді біполярних іонів (цвіттер-іонів, внутрішніх солей). Можливість утворення останніх пов'язана з амфотерністю амінокислот, яка зумовлена наявністю в їх молекулі кислотної (СООН) і основної (ЙН2) груп.
У водному розчині а-амінокислоти існують у вигляді рівноважної суміші, яка складається із цвіттер-іонів, катіонної та аніонної форм:
-сн—соо-
I К
аніонна форма -СООН к катіонна форма Білки Положення такої рівноваги залежить від рН середовища: в силь-нокислому середовищі (рН = 1...2) переважає катіонна форма, в сильнолужному (рН = 13...14) — аніонна. Якщо розчин амінокислоти помістити в електричне поле, то в кислому середовищі молекули переміщуються до катода (катіонна форма), а в лужному—до анода (аніонна форма). Проте для кожної амінокислоти існує характерне значення рН, при якому молекули не переміщуються в електричному полі. При цьому значенні рН, яке називають ізоелектричною точкою, амінокислота знаходиться у вигляді цвіттер-іонів і в цілому електронейтральна. СПОСОБИ ДОБУВАННЯ Раніше було розглянуто загальні методи добування амінокислот, зокрема а-амінокислот. Гідроліз білків,а-Амінокислоти здобувають шляхом лужного, кислотного або ферментативного гідролізу білків. При кислотному гідролізі відбуваються також побічні реакції, наприклад, глутамін і аспарагін гідролізуються до глутамінової та аспарагінової кислот, а триптофан розкладається. Найширше запроваджено ферментативний метод гідролізу. Розділення а-амінокислот у білкових гідролізатах здійснюють за допомогою іонообмінної хроматографії. Мікробіологічний синтез.Деякі мікроорганізми в процесі своєї життєдіяльності виробляють певні а-амінокислоти. Ці мікроорганізми вирощуються на багатих вуглеводами середовищах — крохмалі, меласі, патоці тощо. Таким методом здобувають аспарагінову та глутамінову кислоти, триптофан, лізин та ін. ХІМІЧНІ ВЛАСТИВОСТІ У розділі 20.3.3 було розглянуто хімічні властивості амінокислот і подано реакції, що застосовуються в аналізі а-амінокислот, синтезі пептидів або лежать в основі перетворень а-амінокислот в організмі. А. Реакції по аміногрупі Дезамінування.Під дією нітратної кислоти а-амінокислоти перетворюються на відповідні а-гідроксикислоти: К—СН—СООН + Нг402 —- К—СН—СООН + N. + Н,0 а-амшокислота а-пдроксикислота Глава 23 Білки
не А о он а-амшокислота СООН ЄН—К. + К'ОН а-амінокислота Н,М— ЄН—ІСОбіН і К NН2 «/V сіль а-амшокислоти СООК'
І
сн—к п ешн,
- н.мсн,—к
Поиск по сайту: |

 23.1. а-АМІНОКИСЛОТИ ЯК МОНОМЕРИ БІЛКІВ
23.1. а-АМІНОКИСЛОТИ ЯК МОНОМЕРИ БІЛКІВ

 ■
■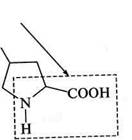
 У гетероциклічних а-амінокислот проліну та оксипроліну а-амінокислотний фрагмент входить до складу гетероциклу:
У гетероциклічних а-амінокислот проліну та оксипроліну а-амінокислотний фрагмент входить до складу гетероциклу:




 Глава 23
Глава 23