 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ЕЛЕКТРОННА ТА ПРОСТОРОВА БУДОВА АЛКАНІВ
За теорією ковалентного зв'язку та електронної будови атомів Карбону і Гідрогену електронні формули молекул метану та етану можна зобразити так: Н
Н -►Н-С-Н-Н
н
І -*• н—с—с—н І І Н н Збуджений атом Карбону бере участь в утворенні 4-х ковалентних зв'язків. Усі зв'язки в молекулі метану рівноцінні: мають однакову довжину, енергію і симетрично напрямлені в просторі. Рівноцінність хімічних зв'язків можна пояснити, звернувшись до гібридизації атомних орбіталей (розд. 3.2.1).
а б Н Рис. 8.1. Схема будови молекул насичених вуглеводнів: а — утворення ст-зв'язків у молекулах метану і етану; б — геометрія молекули етану З Органічна хімія
Вуглеводні.Глава 8 Відстань між атомами Карбону в алканах дорівнює 0,154 нм. Навколо зв'язків С—С в молекулах алканів відбувається обертання, в результаті якого молекула може набувати різних просторових форм — конформацій.
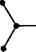
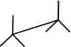
На підставі даних рентгеноструктур-ного аналізу встановлено, що алкани нормальної (нерозгалуженої) будови в кристалічному стані мають зигзагоподібну конформацію. Рис. 8.2. Зигзагоподібна Така будова є для молекули найвигід- конформація алканів нішою, оскільки в цьому випадку всі атоми Карбону відносно один одного перебувають у стані з найменшою енергією. Тому, починаючи з пропану і в наступних вуглеводнях гомологічного ряду метану, атоми Карбону розміщені не вздовж прямої лінії, а зигзагоподібно. При цьому зберігаються тетраедричний кут і відстань між ядрами атомів Карбону. НОМЕНКЛАТУРА Перші чотири члени гомологічного ряду алканів мають тривіальні назви. Назви наступних вуглеводнів з нерозгалуженим ланцюгом утворюються від назв грецьких або латинських числівників, що вказують на кількість атомів Карбону в молекулі, з додаванням суфікса -ан (табл. 8.1). Для позначення нерозгалуженого карбонового ланцюга до назви алканів додається префікс н-. Н3С—СН2—СН2—СН2—СН3 або ./^"Х^Х. и-пентан У назвах алканів з розгалуженим ланцюгом, де дві метильні групи знаходяться на одному кінці карбонового ланцюга, який не має інших відгалужень, застосовується префікс ізо-. Якщо ж на кінці ланцюга є три метильні групи, до назви алкану вводиться префікс нео-:
н3с сн—сн2—сн2—сн3 н3с ізогексан Алкани ____________________________________ ________ ------------------------------------------------------------------------------------------------- 67 СН3
І Н3С С СН2 СН3 СН3 неогексан Назви алканів з розгалуженим ланцюгом утворюють за номенклатурою ШРАС таким чином. 1. За основу назви беруть назву вуглеводню, якому відповідає сн3 , ........ сн3 І н3с—сн—сш~сн2—сн3 І н3с—сн—сн—сн2—сн31 головний ланцюг ланцюг не є головним 2. Нумерують атоми Карбону головного ланцюга, починаючи
12 3 4 5 н,с—сн—сн,—сн,—сн, СН3 2-метилпентан
12 3 4 5 6 7 Н3С СН2 СН—СН2—СН СН2—СН3 З-етил-5-метилгептан Якщо ж на однаковій відстані від обох кінців головного ланцюга розміщені однакові замісники, але з одного боку розгалужень більше, ніж з іншого, то нумерацію починають з того кінця, де більша кількість замісників: Вуглеводні. Глава 8
-сн2- СН, СН, 2,3,5-триметилгексан 3. Повну назву сполуки складають так: Спочатку перелічують в алфавітному порядку назви замісників, указуючи цифру (локант), що відповідає положенню кожного замісника в головному карбоновому ланцюзі. Якщо вуглеводень містить декілька однакових замісників, то їх кількість позначають множними префіксами ди- (ді-), три-, тетра- тощо, а положення кожного з них у головному ланцюзі — зазвичай цифрами. Потім називають вуглеводень, якому відповідає головний карбоновий ланцюг у сполуці, що розглядається. Замісниками при головному карбоновому ланцюзі в алканах є одновалентні залишки алканів, так звані алкільні групи, або шкільні радикали, їх позначають Аік або К (табл. 2.4.). Назви алкільних груп утворюють від назв відповідних алканів, замінюючи суфікс -ан на -іл (-ил). Нижче наведено алкільні радикали, їх скорочені назви та просторову будову, які найчастіше зустрічаються в хімічній літературі:
Н3С— Н3С—СН2—
метил (Ме)
-сн2—
Н3С—СН2 Сн- / Н3С
втор-бутп (лес-Ви) трет-бутп (/-Ви) У наведених назвах префікси втор- (вторинний) і треш- (третинний) указують на атом Карбону з вільною валентністю. Для утворення назв складних розгалужених радикалів вдаються до нумерації карбонового ланцюга радикалу, причому починають нумерацію завжди з атома Карбону, який має вільну валентність: 5 4 3 2 1 Н,С СН- СН СН,—СН,— II СНз СНз 3,4-диметилпентил Назви залишків молекул алканів, які мають дві вільні валентності, утворюють від назв відповідних алканів шляхом заміни суфікса -ан на -ілен {-илен), якщо вільні валентності знаходяться біля різних атомів Карбону: СН2— —СН2 СН2 СН2 СН2 СН2 метилен етилен триметилен Зважаючи на розглянуті правила складання назв алканів за за-місниковою номенклатурою ШРАС, нижченаведені вуглеводні слід називати так: Н3С СН3 4 3 І2 1 1 2 ІЗ 4 5| 6 7 8 Н3С—СН2—С—СН3 Н3С—СН—СН—СН2—С—СН2—СН2—СН3 СНз СНз СН2 СНз 2,2-диметилбутан 5-етил-3-ізопропіл-2,5-диметилоктан За раціональною номенклатурою алкани розглядають як похідні першого представника цього гомологічного ряду — метану (див. розд. 2.2). Вуглеводні. Глава 8 Алкани
Алканам властива структурна і конформаційна ізомерія.
Структурна ізомеріяалканів зумовлена різною послідовністю зв'язування атомів Карбону в молекулі (ізомерія ланцюга). Вона можлива, починаючи з бутану, який має два структурні ізомери: я-бутан та ізобутан. Пентан С5Н12 має три ізомери:
-сн,—сн,—сн,
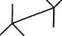
я-лентан Н3С \ сн СН-СН2-СН3 (СН3)2СНС2Н5 \ґ* 3 (СНз)4С
ізопентан, 2-метилбутан неопентан, 2,2-диметилпропан Зі збільшенням кількості атомів Карбону в молекулі алкану кількість структурних ізомерів швидко зростає. Так, гексан С6Н12 має 5 ізомерів, гептан С7Н16 — 9, октан С8Н]8 — 18, декан С10Н22 — 75, ейкозан С20Н42 — 366319. Конформаційна (поворотна)ізомерія алканів зумовлена обертанням окремих фрагментів молекули навколо одинарних С—С зв'язків, при цьому довжини зв'язків, валентні кути не змінюються. Унаслідок обертання молекула може набувати різних просторових форм, або конформацій. Наприклад, молекула етану внаслідок обертання навколо зв'язку С—С може набувати нескінченної множини конформацій, кожна з яких характеризується певним значенням потенційної енергії. Дві крайні конформації називають заслоненою і загальмованою. Для зображення конформацій на площині користуються формулою Ньюмена і перспективними формулами:
Н
н У заслоненій конформації етану атоми Гідрогену метальних груп, якщо дивитися вздовж зв'язку С—С, розташовані один за одним. У загальмованій — атоми Гідрогену однієї метальної групи максимально віддалені від атомів Гідрогену другої. Між заслоненою і загальмованою конформаціями молекула в процесі обертання набуває множини скошених конформацій. Максимальну потенційну енергію має заслонена конформація. Енергетична нерівноцінність різних конформацій пояснюється існуванням у молекулі так званого торсійного напруження (напруження Пітцера), яке зумовлене взаємодією (відштовхуванням) електронних хмар супротивних зв'язків С—Н. У заслоненій конформації супротивні зв'язки максимально наближені, тому взаємодія між ними найбільша. З віддаленням супротивних зв'язків торсійне напруження зменшується і стає мінімальним у загальмованій конформації. Різниця енергій заслоненої і загальмованої конформацій називається енергетичним бар'єром обертання. Для етану він низький (=12 кДж/моль) і легко переборюється молекулою при звичайних температурах за рахунок енергії теплового руху. Однак у кожен момент часу більша частина молекул представлена найбільш енергетично вигідною конформацією. Унаслідок такого низького енергетичного бар'єра виділити ці ізомери неможливо.
Конформації з найменшим запасом енергії називаються конформерами, або конформаційними (поворотними) ізомерами. СПОСОБИ ДОБУВАННЯ 8.4.1. ПРИРОДНІ ДЖЕРЕЛА Основні природні джерела алканів — нафта і природний газ. Нафта — це складна суміш органічних сполук, основними компонентами якої є нерозгалужені та розгалужені алкани. Природний газ складається з газоподібних алканів — переважно метану (до 95 %), етану, пропану і бутану. Для одержання з нафти суміші алканів та інших вуглеводнів її піддають фракційній перегонці. Шляхом перегонки одержують декілька фракцій: петролейний етер, бензин, гас (керосин), дизельне паливо, мазут. Кожна зних — це суміш вуглеводнів, які киплять у певному інтервалі температур (табл. 8.2). Вуглеводні. Глава 8 Алкани
Таблиця 8.2 Фракції, якіодержують перегонкою нафти
З мазуту перегонкою під вакуумом або з водяною парою одержують солярове масло (вуглеводні С!8 — С25), мастила (вуглеводні С28 — С38), вазелінта парафін.Подальшою перегонкою фракцій нафти можна здобути індивідуальні алкани. Природний газ розділяють на складові компоненти шляхом зрідження з подальшою фракційною перегонкою.
Поиск по сайту: |
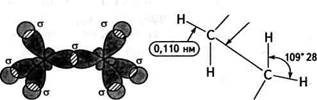 Молекула метану має тетраедричну конфігурацію; електронні хмари атома Карбону знаходяться в 5р3-гібридизованому стані. Валентні кути між зв'зками дорівнюють 109°28' (тетраедричний кут) (рис. 8.1).
Молекула метану має тетраедричну конфігурацію; електронні хмари атома Карбону знаходяться в 5р3-гібридизованому стані. Валентні кути між зв'зками дорівнюють 109°28' (тетраедричний кут) (рис. 8.1).


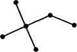

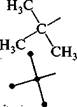
 8.3. ІЗОМЕРІЯ
8.3. ІЗОМЕРІЯ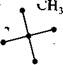 7 ч р н,с V
7 ч р н,с V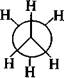

 Н Н
Н Н