 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
СПОСОБИ ДОБУВАННЯ. ФІЗИЧНІ ВЛАСТИВОСТІ
Такі циклоалкани, як циклопентан і циклогексан, а також їх гомологи, входять до складу деяких видів нафти і можуть бути виділені в чистому вигляді. Тому вони мають назву нафтенові вуглеводні. Поряд із цим для одержання циклоалканів існують синтетичні методи, головним з яких є взаємодія а,ю-дигалогеналканів* з металічним натрієм або цинком. Цей метод, що являє собою внут-рішньомолекулярний варіант реакції Вюрца, дозволяє добути три-, чотири- та п'ятичленні циклоалкани: н2с—сн,
Н2С—СН2—Вг
ІН2С—СН2—Вг
1,4-дибромобутан Н2С
2пВг-, не—сн2 Н3С
метилциклопентан За звичайних умов циклопропан і циклобутан — газоподібні речовини. Циклоалкани з величиною циклу від С5 до Сі { є рідинами, далі йдуть тверді речовини (табл. 9.1). Порівняно з відповідними алканами (табл. 8.3) циклоалкани мають дещо вищі температури кипіння та плавлення. Усі циклоалкани практично нерозчинні У воді. * Остання буква грецького алфавіту ш (омега) застосовується для позначення положення замісника, що знаходиться на кінці карбонового ланцюга. Вуглеводні. Глава 9 Циклоалкани
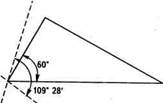
БУДОВА ЦИКЛОАЛКАНІВ Аналогічно алканам у молекулах циклоалканів атоми Карбону знаходяться в .^-гібридному стані. Але якщо молекули алканів мають значну гнучкість завдяки вільному обертанню навколо кар-бон-карбонових зв'язків, то у циклоалканів, незважаючи на можливі конформаційні повороти, молекули являють собою досить жорсткі утворення. Для молекул циклоалканів, як і для алканів, характерні тор-сійне (пітцерівське) напруження, пов'язане із взаємодією хімічних зв'язків у заслоненій або частково заслоненій конформаціях, і напруження Ван-дер-Ваальса, зумовлене взаємним відштовхуванням замісників при зближенні на відстань, близьку до суми їх ван-дер-ваальсівських радіусів. Крім того, для деяких циклоалканів характерне напруження, пов'язане з відхиленням валентних кутів між атомами Карбону в циклі від нормального (тетраедричного) значення. Це напруження дістало назву кутового напруження. Його називають ще байєрівським напруженням, за ім'ям німецького хі-міка-органіка А. Байєра, який запропонував 1885 року теорію напруження циклів. За цією теорією циклоалкани розглядалися як плоскі багатокутники. Єдиним фактором, який визначає міцність циклів, вва- хсалося напруження, викликане відхиленням (у порівнянні з тетраедричним) внутрішніх валентних кутів між атомами Карбону в циклі. Чим більше таке відхилення, тим більше напруження і менш стійкий цикл. У відповідності з цим тричленний цикл, внутрішні валентні кути якого становлять 60°, менш стійкий, ніж чотиричленний (внутрішні кути якого дорівнюють 90°), а той, у свою чергу, менш стійкий, ніж п'ятичленний (кути 108°). (Розрахуйте цей кут для п'ятичленного та шестичленного циклів). Це підтверджувалося наявним на той час експериментальним матеріалом. Але вже для шестичленного циклу експериментальні дані суперечили теорії. Шестичленні цикли (внутрішній кут 120°), які мають значне відхилення валентних кутів від тетраедричного, виявилися стійкішими за п'ятичленні, в яких внутрішні кути найближчі до тетраедричних. Причиною невідповідності теорії Байєра експериментальному матеріалові було помилкове уявлення автора про плоску будову циклів. Насправді єдиним циклом, який має плоску будову, є тричленний. Решта циклів не має плоскої будови. Просторова будова циклоалканів визначається різною конфор-маційною рухливістю атомів Карбону, що залежить від кількості ланок у циклі. Молекула будь-якого циклоалкану прагне набути в просторі такої форми (конформації), в якій сума кутового, тор-сійного та ван-дер-ваальсівського напружень була б мінімальною. З усіх циклоалканів найжорсткішу структуру мають сполуки, які містять тричленний цикл. Оскільки за правилами геометрії три точки завжди лежать в одній площині, тричленний цикл може мати тільки плоску будову. Усі атоми Гідрогену в такому циклі знаходяться в заслоненій конформації, що створює сильне торсій-не напруження (рис. 9.1).
Розрахуємо його ве- Рис. 9.1. Моделі молекули циклопропану:
де 24° 44' — байєрівська напруга в! циклопропані. (Розрахуйте байєрів-ську напругу в циклобутані.) Унаслідок взаємного відштовхування електронних хмар карбон-карбонових зв'язків максимальна електронна густина орбіталей атомів Карбону, що перекриваються в тричленному циклі, розміщена не вздовж прямої, що з'єднує центри зв'язуваних атомів, а за її межами (рис. 9.2).
Чотиричленний цикл, на відміну від тричленного, має все ж таки незначну гнучкість. Внутрішні валентні кути в ньому менш напружені, ніж у тричленному. Намагаючись зменшити торсійне напруження в чотиричленному циклі, один з атомів Карбону виступає з площини останніх трьох атомів на кут 25—30°. Тому чотиричленний цикл не є плоским (його просторову форму зображено на рис. 9.3, а). Ще більша гнучкість характерна для п'ятичленного циклу. На відміну від тричленного і чотиричленного, у п'ятичленному циклі практично відсутнє кутове напруження (відхилення внутрішніх валентних кутів від тетраедричного становить менше 1°). Однак у плоскому п'ятичленному циклі зв'язки С—Н знаходяться в заслоненій конформації, що створює значне торсійне напруження в молекулі. Намагаючись зменшити торсійне напруження в п'ятичленному циклі, кожний з п'яти атомів Карбону по черзі виступає Циклоалкани з площини, в якій розміщені чотири інші атоми Карбону. При цьому кільце начебто перебуває в безперервному хвильоподібно-му русі. Ця неплоска структура дістала назву «конверт» (рис. 9.3, б). Незважаючи на те, що в конформації конверта дещо зростає кутове напруження, це певною мірою компенсується за рахунок зниження торсійного напруження молекули.
а — циклобутану; б — циклопентану У шестичленному циклі, якщо уявити його плоским, внутрішні валентні кути мають становити 120°, що призвело б до значного кутового напруження. Крім того, у плоскій структурі виявляються взаємодії, пов'язані із заслоненням С—Н-зв'язків (торсійне напруження). Уникнути кутового напруження шестичленний цикл може за умови існування в неплоских конформаціях. Так, молекула циклогексану існує у вигляді двох крайніх конформацій — крісла та ванни (човна), які легко переходять одна в одну (рис. 9.4). А б Рис. 9.4. Конформації циклогексану: а — конформація крісла; б — конформація човна (ванни) У вказаних конформаціях усі валентні кути тетраедричні, тому відсутнє кутове напруження. Стійкішою є конформація крісла, оскільки в ній усі атоми Гідрогену та Карбону знаходяться в загальмованій конформації (рис. 9.5, а), що виключає торсійне напруження. У конформації ванни при атомах Карбону, розміщених в «основі» ванни, атоми Гідрогену знаходяться в заслоненій конформа- Вуглеводні. Глава 9 циклоалкани
Н СН та; Н + С12 циклопропан + Вг, Ну /IV А + неї ^С1 хлороциклопропан + НВг
ції (рис. 9.5, б), що створює певне торсійне напруження. Ця конформація, будучи гнучкою структурою, може перетворюватися на стійкішу форму (з меншим заслоненням), яку називають твіст-конформацією (спотвореною ванною): Енергія конформації крісла приблизно на 33 кДж/моль нижча за енергію конформації ванни та І ^-—-^Л V /І ягв/с/я-конформації. Тому за зви- і^^ 7~^ \Чз^^^/ чайних умов переважна частина ^^^г і^^^~-~Ц молекул циклогексану (99,9 %)
існує в конформації крісла, причому кільце зазнає безперервної інверсії, тобто внаслідок обертання навколо карбон-карбонових зв'язків одна конформація крісла переходить в іншу з проміжним утворенням конформації ванни і /ш/с/я-конформації:
твіст-конформація ванни Дві конформації крісла можуть також взаємоперетворюватися без проходження через конформацію ванни.
ХІМІЧНІ ВЛАСТИВОСТІ У хімічному відношенні циклоалкани часто поводяться подібно до алканів. Так, для них характерні реакції заміщення, що відбуваються за радикальним механізмом (5К), наприклад: циклогексан бромоциклогексан Проте циклоалкани з малими циклами (циклопропан і циклобутан) виявляють своєрідні хімічні властивості, пов'язані з особливістю їхньої будови. Через велике кутове і торсійне напруження тричленний цикл і меншою мірою чотиричленний — нестійкі. Тому сполуки, що містять три- і чотиричленні цикли, поряд з реакціями заміщення вступають також у реакції приєднання,що супроводжуються розкриттям циклу. Наприклад, циклопропан у присутності каталізаторів N1 або Рі та нагріванні до 50 °С легко приєднує водень. Реакція відбувається з розривом циклу:
А' - Н2С СН2
Циклобутан приєднує водень при вищій температурі (200 °С). Аналогічно відбувається реакція циклопропану з галогенами і галогеноводнями:
- Вг—Н2С—СН2—СН2—Вг
1,3-дибромопропан
н2с- - Н3С—СН2—СН2—Вг 1-бромопропан Приєднання галогеноводнів до алкілзаміщених циклопропану відбувається у відповідності з правилом Марковникова (див. розд. 10.6.1): Я12
/ \ + НВг-------------- Н3С—СН—СН,—СН3
Йг метилциклопропан 2-бромобутан Циклобутан з галогеноводнями не реагує, а з галогенами вступає в реакцію заміщення 5^.
Вуглеводні. Глава Для циклоалканів та їх похідних характерні реакції ізомеризації циклів.Ці реакції відбуваються в присутності кислот Льюїса як каталізаторів. Так, етилциклобутан при нагріванні з А1С13 ізомеризується в метилциклопентан: * СгІ2—СНз ~~~\ А1С13, / (^^^"СНз етилциклобутан метилциклопентан Реакції ізомеризації досі недостатньо вивчені.
Поиск по сайту: |
 Таблиця 9.1 Фізичні константи деяких циклоалканів
Таблиця 9.1 Фізичні константи деяких циклоалканів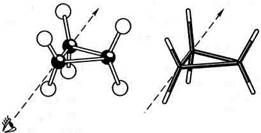 Поворот навколо карбон-карбонових зв'язків неможливий. Внутрішні валентні кути між атомами Карбону в тричленному циклі дуже відхилені від тетраедричного значення, що викликає велике кутове напруження.
Поворот навколо карбон-карбонових зв'язків неможливий. Внутрішні валентні кути між атомами Карбону в тричленному циклі дуже відхилені від тетраедричного значення, що викликає велике кутове напруження.

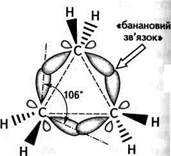 «Банановий» зв'язок.Одинарні зв'язки, що утворюються при цьому, відрізняються від звичайних а-зв'яз-ків. Вони посідають проміжне положення між а- та л-зв'язками і дістали назву т-зв'язків (грец. «тау»), або «бананових» зв'язків. Незважаючи на те, що перекривання за межами трикутника менш ефективне, утворення «бананових» зв'язків для молекули є вигідним процесом, оскільки внаслідок цього кути між зв'язками, які теоретично мають становити 60°, збільшуються до 106°, що відповідно знижує кутове напруження молекули.
«Банановий» зв'язок.Одинарні зв'язки, що утворюються при цьому, відрізняються від звичайних а-зв'яз-ків. Вони посідають проміжне положення між а- та л-зв'язками і дістали назву т-зв'язків (грец. «тау»), або «бананових» зв'язків. Незважаючи на те, що перекривання за межами трикутника менш ефективне, утворення «бананових» зв'язків для молекули є вигідним процесом, оскільки внаслідок цього кути між зв'язками, які теоретично мають становити 60°, збільшуються до 106°, що відповідно знижує кутове напруження молекули.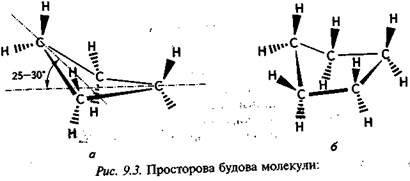


 Рис. 9.5. Проекції Ньюмена конформацій циклогексану: а — конформація крісла; б — конформація ванни
Рис. 9.5. Проекції Ньюмена конформацій циклогексану: а — конформація крісла; б — конформація ванни