|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
КОВАЛЕНТНІ о- І я-ЗВ'ЯЗКИ
Залежно від способу перекриття атомних орбіталей розрізняють ковалентні зв'язки двох типів: а- (грец. «сігма») і я- (грец. «пі») зв'язки. а-Зв'язки утворюються внаслідок перекриття атомних (5, р, сі) і гібридних (зр3, зр1, зр) орбіталей уздовж лінії, яка з'єднує ядра атомів (о-перекриття) (рис. 3.4). Максимальна електронна густина при а-перекритті знаходиться на осі, що з'єднує два ядра. Хімічний зв'язок _££^. ООО СХХХВ а б в г ґ Рис.3.4. Схема перекриття атомних орбіталей при утворенні ст-зв'язку: а) тип 5-і; б) з-р; в) р-р; г) з-зр1; ґ) зр^-зр3 У більшості органічних сполук а-зв'язки утворюються переважно за рахунок перекриття гібридних зр3-, зр2- і 5^-орбіталей, які є енергетично вигіднішими та забезпечують більш ефективне перекриття (рис. 3.5). У молекулі етану (С2Н6) а-зв'язки С—Н утворюються внаслідок осьового я-5/?3-перекриття, а а-зв'язок С—С — за рахунок 5р3-5р3-перекриття орбіталей. Завдяки тому, що максимальна електронна густина при а-перекритті зосереджена в просторі між ядрами атомів, а-зв'язок міцний.
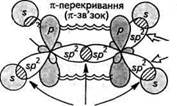
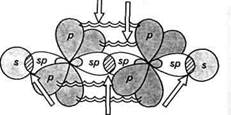
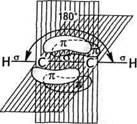
Н Н |. |. Н-г-С-^С-^Н |а |о Н Н етан Рис.3.5. Схема утворення а-зв'зків у молекулі етану Поряд з перекриттям атомних орбіталей уздовж осі, що з'єднує ядра атомів, існує так зване бокове перекриття атомних орбіталей. У ньому беруть участь тільки паралельно розташовані р-атомні орбіталі. Бокове перекриття р-орбіталей називають я-пе-рекриттям, а зв'язок, що утворюється,— я-зв'язком (рис. 3.6, а). Максимальна електронна густина я-зв'язку сконцентрована у двох областях — вище і нижче осі, що з'єднує ядра атомів. Тому я-зв'язок є більш слабким, ніж а-зв'язок. я-Зв'язок утворюється лише між атомами, які знаходяться в зр2- і яр-гібридному стані (рис. 3.6, б). У молекулі етилену (С2Н4) (рис. 3.6, б) електронні хмари атомів Карбону перебувають у я/^-гібридному стані. а-Перекриття трьох гібридизованих орбіталей кожного з атомів Карбону дає розглянуті вище а-зв'язки (два С—Н і один С—С). я-Перекриття двох негіб- Глава З Хімічний зв язок
ст-перекривання (ст-зв'язок) ридизованих р-орбіталей дає карбон-карбоновий л-зв'язок. Унаслідок цього між атомами Карбону утворюється подвійний зв'язок, який складається із а- і л-зв'язків. При цьому л-зв'язок розташований у площині, перпендикулярній до площини а-зв'язку. Аналогічно утворюється л-зв'язок між атомами, що знаходяться в 5/ьгібридному стані. У молекулі ацетилену С2Н2 (рис. 3.6, в) електронні хмари атомів Карбону перебувають у .^-гібридному стані і утворюють між собою потрійний зв'язок, який складається з одного а- і двох л-зв'язків. о-Зв'язок виникає за рахунок перекриття .^-гібридизованих орбіталей, а чотири р-орбіталі утворюють два л-зв'язки, які розташовані у взаємно перпендикулярних площинах. Залежно від кількості електронних пар, які беруть участь в утворенні хімічного зв'язку між двома атомами, розрізняють прості й кратні ковалентні зв'язки. Прості зв 'язки (їх ще називають одинарними) представлені завжди а-зв'язком. До складу кратних зв'язків, поряд із ст-зв'язком, входить також л-зв'язок. Серед кратних зв 'язків вирізняють подвійні і потрійні. Розрив зв'язку.Ми розглянули, як відбувається утворення ковалентного зв'язку між атомами. Але хімічні реакції являють собою єдність двох протилежних процесів — розриву одних зв'язків та утворення інших. Розрив ковалентного зв'язку може відбуватися по-різному — гетеролітично (з утворенням іонів) або гемолітично (з утворенням радикалів):
■*• А- + В іонний розрив, або гетеролітичний радикальний розрив, або гемолітичний Частинки, що утворюються при гемолітичному розриві зв'язку і мають неспарені електрони, називаються вільними радикалами. Зазвичай вони нестійкі, хімічно активні та швидко перетворюються на стійкі молекули. Отже, існує два принципово протилежні способи розриву ковалентного зв'язку — з утворенням іонів та з утворенням вільних радикалів. Який із способів буде реалізований у ході тієї чи іншої реакції, залежить від природи атомів і умов реакції.
Поиск по сайту: |