 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ЕЛЕКТРОННА І ПРОСТОРОВА БУДОВА АЛКЕНІВ
н н іаоД^с7 \£ж \ Н 120° Н
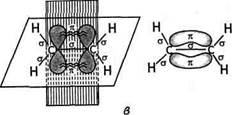
Рис. 10.1. хр2-Гібридизація електронних хмар атома Карбону (а) та схема будови молекули етилену (б, в), геометрія молекули (г)
Розглянемо електронну будову молекул алкенів на прикладі етилену:
£=с;
Н--СОЄ--Н н н У молекулі етилену електронні хмари атомів Карбону перебувають у 5/>2-гібридному стані (див. розд. 3.2.1). Перекривання трьох гібридизованих орбіталей кожного з атомів Карбону дає три о-зв'язки (два С—Н і один С—С), які розташовані в одній площині. Перекривання двох негібридизованних ^-орбіталей дає л-зв'язок. я-Зв'язок розташований у площині, перпендикулярній до площини ст-зв'язків (рис. 10.1). Максимальна електронна густина я-зв'язку сконцентрована у двох областях — вище і нижче осі С—С. Тому л-зв'язок слабший за а-зв'язок. СПОСОБИ ДОБУВАННЯ ' У невеликих кількостях алкени зустрічаються в деяких родовищах нафти і природного газу, з яких можуть бути виділені в чистому вигляді. Як зазначалося раніше, алкени утворюються також при термічному крекінгу вищих алканів. Більшість синтетичних методів добування грунтується на елімінуванні (відщепленні) атомів або груп атомів від молекул алканів, галогеналканів і спиртів.
Дегідрогалогенування моногалогеналканів.При нагріванні мо-ногалогеналканів зі спиртовим розчином натрій (або калій) гідроксиду відщеплюється галогеноводень і утворюються алкени:
Н3С—СН=СН2 + №Вг + Н20
пропен Ненасичені вуглеводні.Глава 10 Алкени
Якщо в молекулі галогеналкану є альтернативні шляхи відщеплення галогеноводню, то реалізується з них переважно той, де подвійний зв'язок утворюється при найбільш заміщеному атомі Карбону. Тобто разом з галогеном від найменш гідрогенізованого сусіднього атома Карбону відходить атом Гідрогену. Наприклад:
?2Н31 Ш
-*Н3С—СН=С—СН3 + N361 + Н20 2-метил-2-бутен (головний продукт) 2-бром-З-метилбутан З 4
-сн—сн3 І 3 СН-> (побічний продукт) Елімінування* галогеналканів може відбуватися за бімолекулярним (Е2) та мономолекулярним (ЕІ) механізмами. Механізм ЕІ (бімолекулярне елімінування).Цей механізм може бути зображений такою схемою:
в + н—с—с—
І _ \ / — В-Н +/С=СХ+ НаГ Реакція за механізмом Е2 відбувається в одну стадію, з утворенням перехідного стану, у формувані якого беруть участь молекули двох реагентів. А тому швидкість такої реакції залежить від концентрації обох реагентів. Процеси розриву і утворення зв'язків у перехідному стані відбуваються синхронно. Найлегше за механізмом ЕІ відбувається елімінування в первинних галогеналканах. * Вивчається за бажанням учителя. Н
Нб'+ Н—С—СН,—Вг 5Р —- н2о + с2н4 + вг Механізм ЕІ (мономолекулярне елімінування). Реакція, яка відбувається за механізмом ЕІ, являє собою двостадійний процес. На першій стадії під впливом розчинника відбувається іонізація молекули галогеналкану з утворенням карбокатіона. Процес іонізації найповільніший, тому визначає швидкість усієї реакції. На другій стадії карбокатіон, що утворився, стабілізується, відщеплюючи протон від р-атома Карбону з утворенням алкену. Стадія 1: І пшшгннп —С-С-Наї =* —С-С+ + НаГ Ні ні галогеналкан карбокатіон Стадія 2: І і V / -с7с+ карбокатіон алкен Акцептором протона часто виявляється сам розчинник, наприклад вода, тому реакція, яка проходить за механізмом ЕІ, зазвичай не вимагає присутності основи як реагенту. У реакції елімінування за механізмом ЕІ найлегше вступають третинні галогеналкани. сн3 сн3 І І з Н3С—СН2—С—СІ 5=* Н3С—СН2—С+ + СІ" —- сн3 сн3 2-хлор-2-метилбутан Н3С—СН=С—СН3 + Н+ сн 3 2-метил-2-бутен Дегалогенування дигалогеналканів.Дигалогеналкани з атомами галогену біля сусідніх атомів Карбону при дії цинку або магнію У водно-спиртовому розчині відщеплюють два атоми галогену, утворюючи алкени:
Ненасичені вуглеводні. Глава 10
-* Н,С—СН==СН—СН, + 2пВг, [В* Вг
2,3 - дибромобутан Дегідратація насичених спиртів. При нагріванні із сильними мінеральними кислотами спирти відщеплюють молекулу води і утворюють відповідні алкени:
Алкени ФІЗИЧНІ ВЛАСТИВОСТІ Подібно до алканів чотири перші представники гомологічного ряду алкенів за нормальних умов — гази, далі йдуть рідини (С5—С17), потім — тверді речовини. Усі алкени практично нерозчинні у воді, добре розчиняються в органічних розчинниках. Температури кипіння н-алкенів, як правило, вищі, ніж їх ізомерів з розгалуженим ланцюгом атомів Карбону; г<ис-ізомери здебільшого мають вищі температури кипіння і нижчі температури плавлення порівняно з /яранс-ізомерами.
(Н0№ етанол
ХІМІЧНІ ВЛАСТИВОСТІ
СН,
Н3С—СН—С—СН3 ІОН Ні З-метил-2-бутанол 2-метил-2-бутен
Дегідрування алканів (промисловий метод). При температурі 300—500 °С у присутності каталізаторів (тонкоздрібнені нікель, хром (III) оксид Сг203 та інші) алкани відщеплюють водень, утворюючи алкени:
- Н3С—СН=СН2 + Н2 пропен Селективне гідрування алкінів. У присутності каталізаторів зі зменшеною активністю (Ре, частково дезактивовані, «отруєні» солями важких металів Реї і Рі) алкіни селективно (вибірково) приєднують водень з утворенням алкенів: н2, ра/рьсоз
-*- Н3С СН—СН2
пропен
ни, в якій розташовані о-зв'язки „2 ^-гібридизованих атомів Карбону (рис. 10.2).
Завдяки такому розміщенню Крім того, подвійний зв'язок впливає на н Л^сн^СНг
Ненасичені вуглеводні. Глава 10 Завдяки надспряженню (ст,я-спряженню), або гіперкон'югації (див. розд. 4.4), атоми Гідрогену, розташовані при а-карбоновому атомі відносно подвійного зв'язку, набувають рухливості та здатності вступати в реакції заміщення ($к), які проходять значно легше, ніж у молекулах алканів. Для алкенів характерні також реакції окиснення, відновлення і полімеризації. Алкени
Приєднання галогенів (галогенування).Алкени досить легко приєднують за місцем розриву подвійного зв'язку хлор і бром, важче — йод з утворенням дигалогенопохідних алканів, що містять атоми галогену біля сусідніх атомів Карбону (віцинальнідигалоге-нопохідні):
=СН, + Вг
Завдяки наявності в структурі я-зв'язку алкени виявляють нук-леофільні (електронодонорні) властивості і вступають у реакції з електрофільними реагентами, такими, як галогени, галогеновод-ні, сульфатна кислота, вода в присутності мінеральних кислот та ін. Ці реакції відбуваються за механізмом електрофільного приєднання (АЕ). Механізм включає дві послідовні стадії:
Стадія 1 6+ 8-
+ Х—¥
X
Стадія 2 X карбокатіон
На стадії 1 електрофільна частинка або молекула електрофіль- 5+ 5- ного реагенту X—-¥ у результаті електростатичної взаємодії з електронною хмарою я-зв'язку утворює з молекулою алкену так званий я-комплекс, який перетворюється на карбокатіон. Потім утворюється ковалентний зв'язок між електрофільною частинкою Х+ і одним з атомів Карбону подвійного зв'язку. На стадії 2 процесу карбокатіон взаємодіє з вивільненою з електрофільного реагенту нуклеофільною частинкою і . Утворюється кінцевий продукт приєднання. Численними дослідженнями встановлено, що механізм цієї реакції включає електрофільну атаку молекулою галогену на л-електрони подвійного зв'язку. Під впливом я-електронної хмари подвійного зв'язку молекула галогену поляризується (Вг5+ -*■ Вг8-) і стає здатною виступати в ролі електрофільного реагенту. Механізм реакції галогенування алкенів можна зобразити так: Ч /8+8-
/С=С^ + X—V галоген /1 с\
X віцинальний дигалогеналкан Ця реакція широко застосовується для якісного і кількісного визначення сполук, які містять подвійний карбон-карбоновий зв'язок. Приєднання галогеноводнів (гідрогалогенування).Алкени приєднують за місцем розриву подвійного зв'язку галогеноводні, утворюючи галогеналкани:
- Н3С—СН2—Вг брометан Приєднання галогеноводнів до алкенів, як і приєднання галогенів, відбувається за гетеролітичним електрофільним механізмом. Спочатку електронодефіцитний атом Гідрогену молекули га-логеноводню (Н5+—X8-) атакує я-електрони подвійного зв'язку Ненасичені вуглеводні.Глава 10 Длкени
... алкен карбокатіон галогеналкан Реакційна здатність галогеноводнів з алкенами зростає в ряду: НР < НС1 < НВг < НІ. Приєднання галогеноводнів до несиметричних алкенів відбувається регіоселектшно, тобто утворюється переважно один із двох можливих продуктів реакції. Наприклад, у разі приєднання НВг до пропену утворюється практично повністю 2-бромопропан, але не 1-бромопропан. У 1869 році російський хімік В. В. Марковников вивів закономірність, яка передбачає напрямок приєднання галогеноводнів і споріднених з ними сполук (сульфатної кислоти, води в присутності мінеральних кислот) за місцем розриву подвійного зв'язку алкенів. її назвали правилом Марковникова. Суть цього правила формулюється так: При взаємодії галогеноводнів і споріднених з ними сполук з несиметричними алкенами атом Гідрогену приєднується за місцем розриву подвійного зв'язку до більш гід-рогенізованого атома Карбону, тобто до атома Карбону, який зв'язаний з більшою кількістю атомів Гідрогену. Наприклад: Вг Н3С С=СН2 + НВг --- •* Н3С—С—СНз СН-і СН-і 2-метилпропен 2-бром-2-метилпролан Такий напрямок приєднання визначається поляризацією молекули несиметричного алкену в нереагуючому стані (статичний фактор) і відносною стійкістю карбокатіона, який утворюється на стадії І, реакції (динамічний фактор). Вплив статичного фактора полягає в тому, що в нереагуючій молекулі несиметричного алкену, внаслідок +/-ефекту з боку алкільних груп, я-електронна густина подвійного зв'язку зміщена до більш гідрогенізованого нена- сиченого атома Карбону. Це визначає найбільш імовірне місце приєднання протона: +/ Н3С Вг С=СН2 + Н—Вг------ Н3С—С—СН3 +/ Н^ Ч.. ' ІН3 Вплив динамічного фактора зумовлений тим, що з двох імовірних варіантів приєднання протона до несиметричного алкену переважно реалізується той, де в ролі проміжного продукту приєднання утворюється стійкіший карбокатіон. Стійкішому карбокатіону відповідає перехідний стан з меншою енергією, а це забезпечує більшу швидкість реакції. Оскільки делокалізація позитивного заряду, а отже, і стійкість карбокатіона зростають зі збільшенням кількості алкільних груп, третинні карбокатіони стійкіші за вторинні, а ті, у свою чергу, стійкіші за первинні. Тому не важко помітити, що приєднання НВг до 2-метилпропену відбуватиметься переважно за напрямком А: Н3С Н3С Вг :с-сн2— ;с-сн3 третинний
Н3С третинний Н3С карбокатіон
Б НзС\ і НзС\ —* ^сн—сн2 —- ^сн—сн2—Вг Н3С первинний Н3(- карбокатіон Слід зазначити, що правило Марковникова не завжди виконується. Деякі реакції йому не підпорядковуються. Наприклад, у присутності пероксидів приєднання бромоводню до несиметричних алкенів відбувається так: тт ~ Н,0,, (К—О—О—К) Н3С—СН=СН2 + Н—Вг —------------- Н3С—СН2—СН2—Вг пропен 1-бромопропан Приєднання води (гідратація).У присутності мінеральних кислот (сульфатна, нітратна, хлорна та ін.) алкени приєднують за розривом подвійного зв'язку воду. Реакція відбувається за правилом Марковникова і приводить до утворення спиртів: Ненасичені вуглеводні. Глава 10 Алкени
:с=сн2 + н2о /ире/и-бутиловий спирт Гідратація алкенів відбувається подібно до приєднання галоге- новоднів, з первісною атакою протона:
Н3С нон
н3с—с—сн3 сн3 н н
У
н3с—с—сн3 сн, Реакція застосовується для промислового синтезу спиртів. Приєднання гіпогалогенних кислот (гіпогалогенування).Алкени приєднують за місцем розриву подвійного зв'язку гіпогалогенні кислоти (НОСІ, НОВг, НОІ) з утворенням галогеногідринів:
- н3с—сн—сн2—сі І 1-хлор-2-пропанол,
он пропіленхлорпдрин Приєднання відбувається за електрофільним механізмом згідно з правилом Марковникова, тобто позитивно заряджений іон галогену спрямовується до більш гідрогенізованого атома Карбону при подвійному зв'язку. Гіпогалогенування звичайно проводять дією на алкен водного розчину галогену: С12 + Н20 НОСІ + НС1
Поиск по сайту: |
 Порядок відщеплення галогеноводню від вторинних і третинних галогеналканів визначається переважно за правилом Зайцева:
Порядок відщеплення галогеноводню від вторинних і третинних галогеналканів визначається переважно за правилом Зайцева:

 Легше відщеплюють воду вторинні і особливо третинні спирти. Відщеплення води в молекулах таких спиртів відбувається за правилом Зайцева:
Легше відщеплюють воду вторинні і особливо третинні спирти. Відщеплення води в молекулах таких спиртів відбувається за правилом Зайцева: Головною структурною особливістю, що визначає реакційну здатність алкенів, є наявність в їх молекулі подвійного карбон-карбонового зв'язку. Атоми Карбону, які зв'язані подвійним зв'язком, знаходяться в стані $р2-гібридизації. Подвійний зв'язок являє собою поєднання ковалентних о- і тг-зв'язків, з яких тг-зв'язок є слабшим за о-зв'язок. Електронна густина тг-зв'язку розміщена симетрично вище і нижче площи-
Головною структурною особливістю, що визначає реакційну здатність алкенів, є наявність в їх молекулі подвійного карбон-карбонового зв'язку. Атоми Карбону, які зв'язані подвійним зв'язком, знаходяться в стані $р2-гібридизації. Подвійний зв'язок являє собою поєднання ковалентних о- і тг-зв'язків, з яких тг-зв'язок є слабшим за о-зв'язок. Електронна густина тг-зв'язку розміщена симетрично вище і нижче площи-
 10.6.1. РЕАКЦІЇ ЕЛЕКТРОФІЛЬНОГО ПРИЄДНАННЯ (АЕ)
10.6.1. РЕАКЦІЇ ЕЛЕКТРОФІЛЬНОГО ПРИЄДНАННЯ (АЕ)
 алкену з утворенням карбокатіона, який потім реагує з галогенід-іоном, утворюючи кінцевий продукт приєднання:
алкену з утворенням карбокатіона, який потім реагує з галогенід-іоном, утворюючи кінцевий продукт приєднання:
