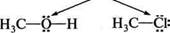|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ТИПИ ХІМІЧНИХ ЗВ'ЯЗКІВ
У 1916 році німецький вчений В. Коссель та американський вчений Дж. Льюїс запропонували електронну теорію хімічного зв'язку, яка стала важливим етапом у розвитку теорії хімічної будови. За електронною теорією хімічний зв'язок розглядається як результат взаємодії зовнішніх електронних оболонок (валентних електронів) атомів. Враховуючи хімічну інертність благородних газів, їх зовнішні електронні оболонки (для гелію — двохелектронна, для неону, аргону і т. д. — восьмиелектронна) вважають найбільш стійкими. Тому кожен атом, утворюючи хімічний зв'язок, приймає, віддає або успільнює валентні електрони таким чином, щоб його зовнішня електронна оболонка відповідала конфігурації інертних газів. Такий принцип заповнення валентних оболонок дістав назву «октетне правило». Залежно від способу утворення розрізняють два основні типи хімічного зв'язку: іонний та ковалентний. Іонний зв'язокутворюється між атомами, які значно відрізняються за електронегативністю. Електронна конфігурація інертного газу досягається в цьому разі шляхом перенесення електрона до більш електронегативного атома. Так утворюються протилежно заряджені іони, які електростатично взаємно притягуються. Тому іонний зв'язок називають ще електровалентним: Глава З Хімічний зв язок
іонний зв'язок У наведеному прикладі іон Натрію має електронну конфігурацію Неону, а іон Хлору — конфігурацію Аргону. Сполуки з іонним зв'язком мають високі температури плавлення, добре розчиняються в полярних розчинниках, у водних розчинах дисоціюють на іони, їх розчини і розтопи проводять електричний струм. Ковалентний зв'язокє основним типом хімічного зв'язку в органічних сполуках. Він утворюється між атомами, рівними або близькими за електронегативністю. Електронна конфігурація інертного газу в цьому разі досягається шляхом успільнення валентних електронів і формування однієї або кількох спільних електронних пар:
І н—с—н І н ковалентний зв'язок Унаслідок успільнення валентних електронів Карбону і Гідрогену утворюються чотири електронні пари, які є спільними для цих атомів. Атом Карбону при цьому набуває електронної конфігурації Неону, а атом Гідрогену — конфігурації Гелію. Кожна з успіль-нених пар електронів складає ковалентний зв'язок, який позначається у вигляді валентного штриху (—). При утворенні ковалентного зв'язку між атомами з однаковою електронегативністю спільна електронна пара розташовується симетрично відносно центрів обох атомів. Такий зв'язок називається ковалентним неполярним: Н3С га СНз ^^ Н3С СНз Якщо в утворенні ковалентного зв'язку беруть участь атоми з різною електронегативністю, то спільна пара електронів зміщується до атома з більшою електронегативністю. Такий зв'язок називається ковалентним полярним: У 8+ 8- н3с|сі -н3с^сі Полярний ковалентний зв'язок зображують у вигляді стрілки (-»), спрямованої до більш електронегативного атома. Літерою 8 (грец. «дельта») умовно позначають дробні (часткові) заряди на атомах. Символ 5+ відображає понижену, а 8" — підвищену електронну густину. Залежно від кількості спільних електронних пар, що виникають між атомами при утворенні зв'язку, розрізняють прості й кратні ковалентні зв'язки. Прості — представлені однією, кратні — двома або трьома парами електронів:
Н0СВС0Н) ав Н—С=С—Н простий / > кратний ковалентний зв'язок ковалентний зв'язок Атоми Нітрогену, Оксигену, Сульфуру, галогенів та деяких інших елементів при утворенні ковалентних зв'язків формують ок-тетну оболонку успільненням не всіх зовнішніх електронів. Частина електронів не бере участі в утворенні хімічних зв'язків. Ці електрони називають неуспільненими, неподіленими, або «-електронами: Н
:№Н ви Н—14—Н Н / неподілеш електронні пари
Донорно-акцепторний зв'язок — це різновид механізму утворення ковалентного зв'язку. Донорно-акцепторний зв'язок утворюється не шляхом успільнення пари електронів, по одному від кожного атома, а за рахунок двох електронів, які надає один з атомів. При цьому атом, що надає пару електронів у спільне користування, називають донором, а частинку, яка приймає електрони,— акцептором. Донор повинен мати пару неподілених електронів. Акцептором може бути протон або інший атом, в якого не вистачає до утворення октету двох електронів. За донорно-акцепторним механізмом, наприклад, відбувається утворення іонів амонію, гідроксонію та ін.: Глава З Хімічний зв'язок
І
Н—И—Н або Н Оскільки пара електронів атома Нітрогену пішла на утворення зв'язку із протоном і стала спільною для обох атомів, атом Нітрогену набуває позитивного заряду. Утворений в іоні амонію за до-норно-акцепторним механізмом ковалентний зв'язок нічим не відрізняється від трьох інших зв'язків. Донорно-акцепторний зв'язок називають ще координаційним, при його утворенні відбувається процес координації неподіленої електронної пари. Водневий зв'язок утворюється внаслідок електростатичної взаємодії між активними атомами Гідрогену в молекулі і атомами з не-поділеною електронною парою (—О—, —N—, —Р, іноді —8—) у цій же або в іншій молекулі. Активними називають атоми Гідрогену, зв'язані в молекулі сильно полярним ковалентним зв'язком, наприклад: —О—Н; =1Ч— Н; —8—-Н. Графічно водневий зв'язок позначають трьома крапками: —О—Н- • '№^ =>4—Н- • -0=. Енергія водневого зв'язку (10—40 кДж/моль) у порівнянні з енергією ковалентного зв'язку (340—360 кДж/моль) невелика. Міжмолекулярні водневі зв'язки виникають між двома або кількома молекулами з утворенням димерів або асоціатів:
,о-н—о.
:с—сн,
'О—Н—0
димер оцтової кислоти с2н5о—н- • -о—н- • -о—н с2н5 с2н5 асоціат етилового спирту Наявність водневих зв'язків впливає на фізичні (температуру кипіння і плавлення, розчинність, в'язкість) та хімічні властивості органічних сполук. Міжмолекулярний водневий зв'язок сприяє підвищенню температури кипіння, а часто й температури плавлення речовини. Так, за рахунок утворення асоціатів температура кипіння етилового спирту С2Н5ОН (78 °С) значно вища, ніж ди- метилового етеру СН3—О—СН3 (-24 °С), що має однакову з ним молекулярну масу, але не здатний утворювати водневий зв'язок. Утворення водневого зв'язку між розчиненою речовиною і розчинником (якщо це можливо) значно збільшує розчинність речовини (вплив водневого зв'язку на розчинність амоніаку). Водневі зв'язки відіграють важливу роль у перебігу різноманітних біохімічних процесів в організмі, вони визначають просторову структуру білків, полісахаридів, беруть участь в утворенні подвійної спіралі ДНК тощо.
Поиск по сайту: |


 N3- +-С1: №+С1
N3- +-С1: №+С1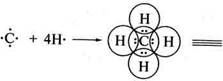 Н
Н