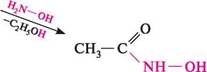
|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Людвіг КЛЯЙЗЕН (КЛАЙЗЕН) (1851-1930)
Німецький хімік-органік. Основні наукові праці присвячені розвитку загальних методів органічного синтезу, ацилюванню карбонільних сполук, ізомерії і таутомерії. Відкрив (1887) реакцію диспропор-ціювання альдегідів з утворенням ес-терів під дією слабких основ (реакція Кляйзена). Відкрив (1887) реакцію одержання (3-оксопохідних естерів у присутності основних каталізаторів (естерова конденсація Кляйзена). Розробив (1890) метод одержання естерів коричних кислот. Вивчив (1900—1905) таутомерію ацетооцтового естеру. Запропонував (1893) особливу колбу для вакуум-перегонки (колба Кляйзена). На відміну від кислотного гідролізу лужний гідроліз естерів — необоротний процес. його механізм полягає в нуклеофільній атаці гідроксид-іоном атома Карбону карбонільної групи з утворенням проміжного аніона, який, відщеплюючи алкоксид-іон, перетворюється в молекулу карбонової кислоти. На заключній стадії реакції алкоксид-іон, маючи сильні основні властивості, відриває протон від молекули кислоти, що утворилася, і перетворюється в молекулу спирту: + он О—К'
К—с—он К — С^ + К'—О" он
К— с
О-н + К'—О" К—с' + К'—ОН 0~ При лужному гідролізі луг виступає не як каталізатор, а як реагент. лужний гідроліз естерів часто називають омиленням. ця назва пов'язана з тим, що при лужному гідролізі жирів, якими є естери гліцерину і високомолекулярних карбонових кислот, утворюються мила. Взаємодія з амоніаком, первинними та вторинними амінами.При дії на естери амоніаку, первинних та вторинних амінів утворюються відповідно незаміщені, N-заміщені і N,N-дизаміщені аміди карбонових кислот: ФУнКЦІОнаЛЬнІ ПОхІДнІ КарБОнОВих КиСЛОт --------------------------------------------------------------------- 449 сн3—с' + н2й— сн3 —► сн3—с^ +с2н5—он О—С2Н5 N11—СН3 етилацетат >[-метилацетамід За механізмом реакції такого типу принципово нічим не відрізняються від ви-щенаведеного механізму лужного гідролізу: > -.. О к— с'^ += =± я— с—й—сн3—*► к— с—Nн— сн3—*► —► К — С^ + С2Н5—ОН мі—сн3 Оскільки більшість естерів легкодоступні і порівняно легко синтезуються, ця реакція широко використовується в синтезі амідів карбонових кислот. Взаємодія з гідразинами та гідроксиламіном.При дії на естери гідразинів і гід-роксиламіну утворюються відповідно гідразиди і гідроксамові кислоти (гідрокси-аміди):
О *<£$?*■ О—ед СН3 С. етилацетат КН —N1^ гідразид гідроксиамід оцтової кислоти оцтової кислоти Взаємодіязі спиртами(реакція переестерифікації). При взаємодії зі спиртами в молекулі естеру відбувається заміна одного спиртового залишку на інший. ця реакція отримала назву «реакції переестерифікації». Переестерифікація каталізується мінеральними кислотами або лугами і є оборотною реакцією. Для зміщення рівноваги вправо видаляють більш леткий спирт. Тому практичне значення переестерифікація має в тому випадку, коли до складу вихідного естеру входить залишок низькокиплячого спирту (часто — метилового). Тоді внаслідок переестерифікації утворюється метиловий спирт, який можна видалити з реакційного середовища. При цьому рівновага зміщується вбік кінцевих продуктів: у* Н+ або ОН /Р СН3—С^+ С2Н5ОН осн3 ос2н5 метилацетат етилацетат Глава 26 естерова конденсація(конденсація Кляйзена). естери карбонових кислот, що містять атоми Гідрогену в а-положенні, у присутності сильних основ, таких як алкоксиди, вступають у реакцію конденсації з утворенням естерш Р-оксокислот (|3-кетоестерш). ця реакція називається «конденсацією Кляйзена»: ^° С2Н5ОКа II ^° 2СН3—с' ОС2Н5 ОС2Н5 етилацетат ацетооцтовий естер Механізм реакції включає три стадії. На першій стадії алкоголят-іон відщеплює від а-атома Карбону молекули естеру протон, утворюючи мезомерно стабілізований карбаніон (І). На другій стадії карбаніон, виступаючи як нуклеофіл, атакує атом Карбону карбонільної групи другої молекули естеру з утворенням продукту приєднання (ІІ), який на третій стадії відщеплює алкоксид-іон, перетворюючись на кінцевий продукт реакції (ІІІ):
І. Стадія II &........................... /> V СН3—С^* + СН2—с' :<=► СН3—С —СН2—С^ О-С2Н5 ОС2Н5 ^^ ОС2Н5 II. Стадія III СН3—С —СН2—С^ ^=*: СН3—С—СН2—Сх + С2Н5О~ Свсд III. естерова конденсація застосовується для промислового виробництва ацетооцтового естеру. якщо конденсації піддаються два різних естери, кожний з яких містить а-атом Гідрогену, у процесі реакції утворюється суміш чотирьох можливих продуктів. ФУнКЦІОнаЛЬнІ ПОхІДнІ КарБОнОВих КиСЛОт
Поиск по сайту: |