 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ФУнКЦІОнаЛЬнІ ПОхІДнІ КарБОнОВих КиСЛОт
Елекгрофільні центри к—с
Ангідриди карбонових кислот легко реагують з різними нуклеофільними реагентами і використовуються для введення в їх структуру ацильних груп. Так, при взаємодії з водою ангідриди повільно гідролізуються з утворенням відповідних кислот. Реакція прискорюється при нагріванні: (СН3СО)2О + Н2О —► 2СН3СООН При обробці лінійних ангідридів спиртами утворюються естери:
о .0 .0
сн3—с^ + сн3—с^
ОС2Н5 ОН етилацетат циклічні ангідриди реагують зі спиртами з утворенням неповних естерів ди-карбонових кислот:
^О ^О
о + с2н5он У о бурштиновий ангідрид моноетиловий естер бурштинової кислоти При взаємодії лінійних ангідридів з амоніаком, первинними або вторинними амінами утворюються аміди карбонових кислот: ,О
сн3-с( Н2]ЧГ— С2Н5
сн3-с( о етиламщ оцтової кислоти циклічні ангідриди реагують з амоніаком і первинними амінами з утворенням неповних амідів дикарбонових кислот, які при нагріванні циклізуються в іміди:
Ші, фталімід Глава 26 як у карбонових кислотах, так і в молекулах їх ангідридів атоми Гідрогену при а-атомах Карбону рухливі. За участі зв'язку С—Н в а-положенні ангідриди карбонових кислот у присутності основ (солі карбонових кислот, третинні аміни) вступають у реакцію конденсації з ароматичними альдегідами, утворюючи нена-сичені аренкарбонові кислоти (див. реакцію Перкіна, с. 398):
(СН3СО)2О СН3СОО№+; і
бензальдегід оцтовий ангідрид сн3соон корична кислота ОКРЕМІ ПРЕДСТАВНИКИ. ВИКОРИСТАННЯ Оцтовий ангідрид(CH3CO)2O. Безбарвна рідина з різким запахом (т. кип. 140°С), подразнює слизові оболонки очей і дихальних шляхів, викликає опіки шкіри. З водою повільно реагує, утворюючи оцтову кислоту, розчиняється в етанолі, етері, бензені, оцтовій кислоті. Використовують як ацетилюючий реагент у виробництві ацетилцелюлози, вінілацетату, диметилацетаміду, лікарських засобів (ацетилсаліцилової кислоти 0 тощо).
Використовують у синтезі лікарських препаратів (фталазол, фтазин тощо), у виробництві алкідних смол, пластифікаторів, барвників.
Поиск по сайту: |
 ................. * V
................. * V




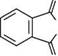 Фталевий ангідрид.Біла кристалічна речовина (т. пл. 130,8°С), •/-у легко сублімується, розчинна в етанолі.
Фталевий ангідрид.Біла кристалічна речовина (т. пл. 130,8°С), •/-у легко сублімується, розчинна в етанолі.