 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ГІДрОКСиЛЬнІ ПОхІДнІ ВУГЛеВОДнІВ. етери. бензендіазоній хлорид
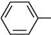
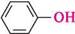
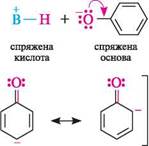
+ N2 + на бензендіазоній хлорид фенол ФІЗИЧНІ ВЛАСТИВОСТІ Найпростіші феноли — це в'язкі рідини або низькоплавкі тверді речовини з дуже специфічним стійким запахом («карболовий запах»). Фенол розчинний у воді (9 частин на 100 частин води), інші феноли у воді малорозчинні. Більшість фенолів — безбарвні речовини, однак при зберіганні під дією кисню повітря вони можуть окиснюватися і набувати темного забарвлення за рахунок домішки продуктів окиснення. ХІМІЧНІ ВЛАСТИВОСТІ Усі можливі реакції фенолів можна розподілити на реакції за участі зв'язків О—Н, С—О, арильного радикала, а також реакції відновлення та окиснення. Однак унаслідок ^,я-кон'югації неподіленої пари електронів атома Оксигену з я-електронною системою ароматичного ядра міцність зв'язку C—O значно більша, ніж у спиртів. Тому реакції фенолів з розривом зв'язку C—O проходять дуже важко. Тільки при дії PCl3 або PCl5 у жорстких умовах гідроксильна група заміщується на атом галогену, а основним продуктом є естер фосфатної або фос-фітної кислоти відповідно: 4С6H5OH + РСЬ (C6H5O)3P=O трифенілфосфат C6H5Cl + хлоробензен HCl РЕАКЦІЇ ЗА УЧАСТІ ЗВ'ЯЗКУ О—Н Кислотні властивості.Феноли — сильніші ОН-кислоти, ніж спирти. це пов'язано з тим, що неподілена пара електронів атома Оксигену в молекулі фенолу зміщена до ядра (+М-ефект OH-групи), що приводить до утворення часткового позитивного заряду 5+ на атомі Оксигену та збільшення полярності зв'язку О—Н порівняно зі спиртами. Крім того, фенолят-іон (феноксид-іон), який утворився, має підвищену стабільність за рахунок делокалізації негативного заряду по ароматичному радикалу:
в + н—о
Глава 22 Доведенням більш сильних кислотних властивостей фенолів порівняно зі спиртами може слугувати їх реакція з водними розчинами лугів з утворенням солей — фенолятів (феноксидів): С6Н5—ОН + С6Н5— (Жа Н2О фенол натрій фенолят На відміну від фенолів, спирти, як слабші кислоти, здатні утворювати алкоголяти тільки при взаємодії з лужними металами. У водному розчині феноляти лужних металів частково гідролізовані (як солі слабких кислот і сильних основ), і тому їх розчини мають лужну реакцію. С6Н5— (Жа Н2О С6Н5—ОН + Під дією розчинів карбонових і мінеральних кислот, у тому числі й карбонатної (вугільної) кислоти, із солей одержують вільні феноли. С6Н5— СО2 Н2О в— ОН + На кислотність фенолу значно впливають замісники в ароматичному ядрі (див. с. 92). Так, уведення в n-положення бензенового ядра молекули фенолу електроноакцепторних замісників (—NO2, —CN, —Hal тощо) підсилює кислотні властивості фенолу. Уведення ж у n-положення електронодонорних замісників (—H2, —CH3 і под.) приводить до зниження кислотності, оскільки при цьому зменшується зміщення електронів зв'язку O—H до атома Оксигену, що утруднює відрив протона:
кислотні властивості фенолів
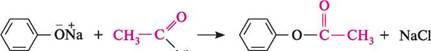
С2Н5— Вг натрій фенолят етилфеніловий етер Метилові етери фенолів зазвичай одержують взаємодією фенолятів з диметил-сульфатом (О-алкілювання):
метилфеніловий етер Аналогічно проходить реакція утворення естерів при взаємодії фенолят-іона з ацилюючими реагентами — галогенангідридами та ангідридами карбонових кислот (О-ацилювання): ГІДрОКСиЛЬнІ ПОхІДнІ ВУГЛеВОДнІВ.етери
СІ ацетилхлорид фенілацетат У реакцію О-ацилювання можуть вступати і феноли:
оцтовий ангідрид фенілацетат Ацилювання фенолів карбоновими кислотами в присутності сульфатної кислоти, на відміну від ацилювання спиртів, практично не використовується, тому що ця реакція через зменшення електронної густини на атомі Оксигену в молекулі фенолу проходить значно повільніше. РЕАКЦІЇ ЕЛЕКТРОФІЛЬНОГО ЗАМІЩЕННЯ В АРОМАТИЧНОМУ КІЛЬЦІ (SE) Гідроксильна група, виявляючи електронодонорні властивості, дуже сильно активує бензенове кільце відносно електрофільних реагентів. Реакції електро-фільного заміщення SE у фенолах перебігають в о- і п-положення. Фенолят-іони в реакції SEще активніші, ніж відповідні феноли. Через високу активність фенолів необхідно вживати спеціальних заходів для запобігання реакції окиснення та по-лізаміщення. Галогенування.Зазвичай для введення атома галогену в бензенове кільце потрібні каталізатори — кислоти льюїса. Реакція галогенування фенолів, з огляду на їх високу реакційну здатність, перебігає досить легко за відсутності каталізатора. Вони знебарвлюють бромну воду, причому відбувається заміщення всіх атомів Гідрогену в о- і п-положеннях:
ОН + ЗНВг
фенол 2,4,6-трибромофенол (осад білого кольору)
он + 2НВг
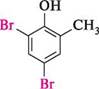
о-крезол 2,4-дибром-6-метилфенол Глава 22 Подальше бромування призводить до утворення так званого «тетрабромофе-нолу»: ОН Вг 1 Вг Вг + Вг, Н,0
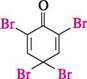
2,4,4,6-тетрабром- 2,5-циклогексадієнон; «тетрабромофенол» + НВг При цьому відбувається порушення ароматичності бензенового кільця. Для введення в молекулу фенолу одного або двох атомів галогену необхідні спеціальні умови. якщо бромування проводити в низькополярному розчиннику (CCl4, CHCl3), утворюються переважно монобромофеноли з переважною кількістю пара-ізомеру:
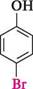
ОН ОН + 2НВг л-бромофенол о-бромофенол
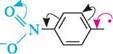
В інших умовах можна домогтися переваги дибромозаміщеного фенолу: + 2НВг Вг 2,4-дибромофенол При хлоруванні утворюється переважно орто-ізомер. йод безпосередньо не йодує феноли. нітрування. Реакція нітрування фенолу відбувається при кімнатній температурі вже при обробці розведеною нітратною кислотою, тоді як для нітрування бензе-ну використовують нітруючу суміш. При цьому утворюється суміш о- і п-нітро-фенолів:
+ 2Н0—N02 (Розв.) 25 °С ОН + 2Н2О
фенол о-нітрофенол N02 л-нітрофенол При дії концентрованої нітратної кислоти фенол перетворюється в 2,4,6-три-нітрофенол (пікринову кислоту):
Поиск по сайту: |
 8+
8+

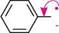
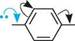 о—н
о—н



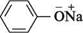
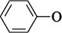





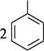

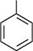
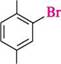

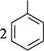
 ОН
ОН