|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ГІДрОКСиЛЬнІ ПОхІДнІ ВУГЛеВОДнІВ. етери
Спиртове бродіння вуглеводів(глюкози, фруктози, сахарози тощо) дозволяє одержати етиловий спирт: с6н12о6 дріжджі, ФІЗИЧНІ ВЛАСТИВОСТІ Насичені одноатомні спирти — безбарвні рідини або кристалічні речовини зі специфічним запахом (табл. 22.1). Таблиця 22.1 Фізичні характеристики деяких спиртів
Глава 22 322Г Нижчі члени гомологічного ряду мають характерний «спиртовий» запах; бута-нолам і пентанолам притаманний неприємний «сивушний» запах; вищі алканоли мають приємний фруктовий запах. циклоалканоли, ненасичені та ароматичні спирти здебільшого рідкі або тверді речовини з приємним ароматним запахом. Так, циклогексанол має запах камфори, пропаргіловий спирт НС3С—СН2—ОН має запах герані, а 2-фенілетанол С6Н5—СН2—СН2—ОН — запах троянд. Спирти мають вищі температури плавлення і кипіння, більшу розчинність у воді, ніж відповідні вуглеводні. Така різка відмінність між фізичними властивостями спиртів і алканів зумовлена насамперед тим, що спирти є полярними сполуками. Вони мають два полярні зв'язки С—О і О—Н. Існування на атомах гідроксильної групи часткових зарядів протилежного знака приводить до міжмолекулярної взаємодії гідроксильних груп і утворення водневих зв'язків: 8-8+ 8-8+ 8-8+ ....о^н....о^н....о^н... К к к Унаслідок такої взаємодії відбувається асоціація молекул спирту. Водневі зв'язки значно слабші за ковалентні, проте їх утворення суттєво зменшує леткість, підвищує температуру кипіння, тому що асоціати, які утворюються, мають більшу молекулярну масу. Наприклад, етан кипить при -89 °С, тоді як етанол — при 78,5 °С. Спирти з невеликою молекулярною масою добре розчинні у воді. Метанол, етанол, пропаноли, аліловий і пропаргіловий спирти змішуються з водою в усіх співвідношеннях. У водних розчинах спиртів утворюються водневі зв'язки між молекулами води і спирту:
Водневі зв'язки, які утворюються, міцніші, ніж зв'язки між молекулами спирту, що приводить до зменшення сумарного об'єму води і спирту при змішуванні (явище контракції спирту). ХІМІЧНІ ВЛАСТИВОСТІ Для спиртів характерні реакції за участі зв'язків О—Н, C—O і реакції окис-нення. Присутність у молекулі спирту кратних зв'язків або ароматичного радикала не змінює принципово хімічні властивості гідроксильної групи, а надає спиртам властивостей, характерних для ненасичених або ароматичних сполук (див. розд. 10.5 і 14.5). Кислотно-основні властивості. Спирти виявляють слабкі кислотні і слабкі основні властивості, тобто вони є амфотерними речовинами. Їх кислотні властивості зумовлені рухливістю атома Гідрогену гідроксильної групи. Атом Оксигену як більш 8- 5+ електронегативний елемент зміщує електронну густину зв'язку -►0-<-Н на себе, утворюючи при цьому на атомі Гідрогену частковий позитивний заряд. Під дією сильних основ спирти відщеплюють від гідроксильної групи протон, тобто виявляють властивості OH-кислот. Однак спирти є слабшими OH-кислотами, ніж ГІДрОКСиЛЬнІ ПОхІДнІ ВУГЛеВОДнІВ. етери «З і «З вода. це зумовлено позитивним індуктивним ефектом вуглеводневого радикала, зв'язаного з гідроксильною групою. Додаткове збільшення електронної густини на атомі Оксигену за рахунок +I-ефекту вуглеводневого радикала приводить до зменшення полярності зв'язку О—Н і відповідно рухливості атома Гідрогену. Тому при переході від первинних спиртів до третинних кислотні властивості знижуються:
5+ > 5'+ > 8"+ кислотні властивості спиртів
2С2Н5—ОН+ 2№ —► 2С2Н5—О Ш+ + Н2| етанол натрій етилат; натрій етоксид У спиртовому середовищі алкоголяти піддаються іонізації з утворенням алкоксид-аніона, який виявляє сильні нуклеофільні і сильні основні властивості: натрій алкоксид алкоксид-аніон Саме тому алкоголяти широко використовуються в органічному синтезі як сильні основи та сильні нуклеофільні реагенти. Алкоголяти легко розкладаються під дією води до вихідних спиртів, що підтверджує більш низьку кислотність спиртів порівняно з водою: С2Н5—О №+ + НОН^г>- С2Н5—ОН+ ИаОН Через низьку кислотність спирти майже не вступають у реакцію з лугами. Основні властивості спиртів зумовлені наявністю на атомі Оксигену гідроксильної групи неподіленої пари електронів, здатної до приєднання протона. Так, із сильними кислотами первинні спирти утворюють на холоді нестійкі солі алкілоксонію:
С2Н5—ОН+ НВг с2н5- 6 Вг" етилоксоній бромід Алкоксонієві солі утворюються як проміжні продукти в багатьох реакціях за участі спиртів. Основні властивості спиртів порівняно з кислотними змінюються за протилежним порядком, тобто при переході від первинних до третинних спиртів основні властивості зростають: Глава 22 324 Г сн3 2-пропанол 2-метил-2-пропанол 8"- > 8'- > 8-Основні властивості спиртів
0' етилгідросульфат Н+; 0...5 °С ; С2Н5—О—Н + НО — N02 етилнітрат О о Н,8О4 (конц.) с2н5—о—н + но—с—сн3 етилацетат Реакція естерифікації оборотна. Для зміщення рівноваги вправо або беруть надлишок одного з реагентів (зазвичай спирту), або видаляють один із продуктів реакції. Взаємодія спиртів з карбоновими кислотами відбувається в присутності каталізатора, найчастіше концентрованої сульфатної кислоти. швидкість реакції естерифікації залежить від будови спирту і карбонової кислоти. Російським хіміком М. О. Меншуткіним установлено, що при одній і тій же кислоті швидкість утворення естерів зменшується в ряду спиртів: первинний, вторинний, третинний. Реакції спиртів з карбоновими кислотами відбуваються за механізмом нуклеофіль-ного заміщення (див. с. 411). Молекула води, яка виділяється в процесі взаємодії, утворюється за рахунок атома Гідрогену групи —OH спирту і гідроксильної групи карбонової кислоти. Дегідратація спиртів.При нагріванні спиртів у присутності концентрованої сульфатної кислоти, безводної фосфатної кислоти або при пропусканні парів спирту над каталізатором алюміній оксидом Al2O3 спирти відщеплюють воду, тобто піддаються дегідратації. Залежно від природи спирту та умов проведення реакції дегідратація може проходити міжмолекулярно і внутрішньомолекулярно. При міжмолекулярній дегідратації спиртів утворюються етери: с2н5—о—н + но—с2н5 діетиловий етер Унаслідок внутрішньомолекулярної дегідратації утворюються алкени: сн3—сн2—он ГІДрОКСиЛЬнІ ПОхІДнІ ВУГЛеВОДнІВ.етери Внутрішньомолекулярна дегідратація в ряду вторинних і третинних спиртів здійснюється за правилом Зайцева: протон відщеплюється від сусіднього, менш гідро-генізованого атома Карбону. сн3—сн2—сн—сн3 он 2-бутанол сн3—сн=сн—сн3 2-буіен Н20 Міжмолекулярна і внутрішньомолекулярна дегідратації спиртів — це два конкурентні процеси, кожний з яких за певних умовах може стати домінуючим. Відщеплення води від двох молекул спирту з утворенням етерів — міжмолекулярна дегідратація — стає переважним процесом при нагріванні спиртів у присутності каталітичних кількостей мінеральної кислоти (спирт у надлишку) при температурі 140-160 °С. Внутрішньомолекулярна дегідратація, тобто перетворення спирту в алкен, стає домінуючим при нагріванні спиртів з надлишком мінеральної кислоти при температурі вище 170°С. Особливо легко вона перебігає в ряду третинних спиртів. У випадку пропускання парів спирту над Al2O3 при температурі 200—250°С відбувається міжмолекулярна дегідратація з утворенням етерів, а при вищій температурі (300—400°С) проходить внутрішньомолекулярна дегідратація, тобто утворюються алкени. Міжмолекулярна дегідратація спиртів відбувається за механізмом 8^ або SN1. При цьому спочатку молекула спирту під дією мінеральної кислоти протонується з утворенням оксонієвого катіона, а потім проходить заміщення групи —OH:
Н Н Н
к—с—он + н4 н
первинний спирт Механізм SN2 включає утворення перехідного стану, який формується в процесі нуклеофільної атаки електрофільного атома Карбону оксонієвого катіона другою молекулою спирту:
6+ к—с—он+ к—с—о
І ■■••-■-"І н спирт оксонієвий катіон н н к—с—6—с—к н н н
н І .. І / к—с—о—с—о
І І /\ \ н н н н перехідний стан н н к—с—о—с—к н н етер Глава 22 326Г Механізм SN1 проходить через стадію утворення карбонієвого катіона: к—с—о ' н І ХЧ. IV оксонієвий катіон карбонієвий катіон
к—с+ + но'—с—к ^ К к к н к спирт етер Подібно до галогеналканів первинні спирти вступають у реакцію міжмолекулярної дегідратації зазвичай за механізмом SN2, третинні — за механізмом SN1, вторинні можуть реагувати як за SN2-, так і за SN1-механізмом. Внутрішньомолекулярна дегідратація спиртів залежно від їх будови може перебігати за механізмами E1 і E2. Первинні спирти реагують здебільшого за механізмом Е2, а вторинні та особливо третинні — за механізмом Е1. як і у випадку нуклеофільного заміщення, елімінування спиртів проходить через стадію утворення оксонієвого катіона. лімітуючою стадією процесу є розщеплення цього катіона на молекулу води і карбокатіон. елімінування завершується швидким відщепленням В-протона від карбокатіона під дією слабкої основи (молекули води, спирту тощо) з утворенням алкену. Схема внутрішньомолекулярної дегідратації спирту за механізмом Е1:
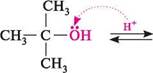
трет-бутловий спирт
2-метилпропен Взаємодія з галогеноводневими кислотами.При взаємодії спиртів з галогеновод-невими кислотами (HCl, HBr, HI) гідроксильна група заміщається на атом галогену й утворюються галогеналкани. Реакція оборотна. Для зміщення рівноваги вправо зазвичай з реакційного середовища видаляють воду або галогеналкан: с2н5— он + ні За реакційною здатністю зі спиртами галогеноводневі кислоти розташовуються в ряд: HCl < HBr < HI. З йодидною і бромідною кислотами реакція перебігає легко,
Поиск по сайту: |

 Полярність зв'язку О—Н у спиртах визначає її схильність до гетеролітичного розриву. Спирти як кислоти реагують з лужними металами, утворюючи алкоголяти (алкоксиди):
Полярність зв'язку О—Н у спиртах визначає її схильність до гетеролітичного розриву. Спирти як кислоти реагують з лужними металами, утворюючи алкоголяти (алкоксиди):
 нуклеофільний центр
нуклеофільний центр
 к к к к
к к к к