 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Траугот ЗАНДМЕЙЄР (1854-1922)
Швейцарський хімік. Один з піонерів створення промисловості синтетичних барвників. Відкрив (1884) реакцію заміни діазогрупи в ароматичних або гетероароматичних сполуках на атом галогену шляхом розкладання солі діазонію в присутності галогенідів купруму(І) (реакція Зандмейєра). Запропонував новий спосіб одержання ізатину (взаємодією аміну з хлоралем і гідроксиламіном). діазогрупа заміщується на атом Гідрогену. Унаслідок вільнорадикального заміщення сіль діазонію перетворюється на ароматичний вуглеводень:
Н3РО2
г + неї + н3ро3 При використанні як відновника спиртів поряд з відновленням солі діазонію відбувається побічна реакція з утворенням етерів:
етилфеніловий етер Реакція заміщення діазогрупи на атом Гідрогену застосовується в органічному синтезі як непрямий метод видалення аміногрупи з ароматичного ядра після її використання для необхідної орієнтації заміщення. Таку сполуку, як 1,3,5-три-бромобензен, неможливо добути прямим бромуванням бензену. Однак її легко можна одержати з аніліну через утворення 2,4,6-триброманіліну з подальшим ді-азотуванням і відновленням солі діазонію:
Вг 2,4,6-триброманілін
2,4,6-трибромобензен-діазоній бромід Н3РО2; Н20
Вг 1,3,5 -трибромобензен РЕАКЦІЇ БЕЗ ВИДІЛЕННЯ АЗОТУ Утворення діазопохідних.Солі діазонію, будучи електрофільними реагентами, вступають у реакції з різними нуклеофільними реагентами з утворенням діазопо- ДІаЗО- та аЗОСПОЛУКи хідних. Так, при додаванні до розчину солі діазонію лугів утворюються діазотати. З первинними і вторинними амінами в слабколужному і нейтральному середовищах солі діазонію утворюють діазоаміносполуки (триазени). При дії на солі діазонію ціанідами лужних металів утворюються діазоціаніди:
2каон с6Н5-N=N-ОNа натрій діазотат
С6Н5— N=N—NН— СН3 З -метил-1 -фенілтриазен С6Н5— N=N— СN бензендіазоціанід Відновлення солей діазонію.При відновленні солей діазонію в м'яких умовах (дією станум(II) хлориду в хлоридній кислоті, цинкового пилу в оцтовій кислоті, натрій сульфіту тощо) утворюються арилгідразини:
НС1 фенілгідразин гідрохлорид реакція азосполучення.Солі діазонію реагують з фенолами в слабколужному середовищі та ароматичними амінами в слабкокислому середовищі, утворюючи азосполуки загальної формули Ar—N=N—Ar. ця реакція одержала назву «реакція азосполучення». Сіль діазонію в реакції азосполучення називають діазокомпонентою, а фенол або ароматичний амін — азокомпонентою.
азокомпонента (X = —ОН; — 1ЧН2; — 1ЧНК; — 1ЧК2)
N=N Н о-комплекс -іґ азосполука
Шон
4-гідроксиазобензен ОН За механізмом взаємодії реакція азосполучення належить до реакцій електро-фільного заміщення в ароматичному ряду. Атакуючим електрофільним реагентом у реакції виступає діазокатіон. Активність діазокомпоненти в реакціях SE залежить від природи замісників в ароматичному ядрі (особливо в орто- і пара-положенні). Глава 21
осн, 8О3Н N0, Активність діазокомпоненти
Великий вплив на перебіг реакції азосполучення має рН реакційного середовища. Реакцію з фенолами проводять у слабколужному середовищі, де вони перетворюються в більш реакційноздатні феноляти, оскільки група —О" має значніші електронодонорні властивості, ніж група —ОН:
Сильнолужне середовище неприпустиме, тому що в цих умовах сіль діазонію перетворюється в діазотат, який не вступає в реакцію азосполучення. З ароматичними амінами реакцію азосполучення проводять у слабкокисло-му середовищі (рН = 5...7). У сильнокислому середовищі реакція не проходить, оскільки в цьому разі аміногрупа практично повністю перетворюється в амонійну, яка дезактивує бензенове ядро в реакціях SЕ:
Катіон діазонію, будучи електрофільним реагентом, атакує в бензеновому кільці ароматичного аміну або фенолу атом Карбону з найбільшою електронною густиною, утворюючи с-комплекс, який відщеплює протон і перетворюється в азосполуку (див. механізм, с. 309).
У випадку первинних і вторинних ароматичних амінів поряд з атакою бензено-вого кільця діазокатіон конкурентно атакує атом Нітрогену аміногрупи. Унаслідок цієї атаки утворюються діазоаміносполуки (триазени), які при нагріванні в кислому середовищі піддаються перегрупуванню з утворенням азосполук: ДІаЗО- та аЗОСПОЛУКи
перегрупування 4-аміноазобензен Використовуючи в реакції азосполучення різні діазо- і азоскладові, можна одержати велику кількість азосполук. З огляду на те що всі азосполуки забарвлені речовини, реакція азосполучення широко застосовується у фармацевтичному аналізі для підтвердження тотожності лікарських препаратів, що містять у своєму складі первинну ароматичну аміногрупу. АЗОСПОЛУКИ Азосполуками називають органічні сполуки, які містять у своєму складі угруповання —N=N— (азогрупу), зв'язане з двома вуглеводневими радикалами. Залежно від природи вуглеводневого радикала розрізняють аліфатичні і ароматичні азосполуки. Найважливіше значення мають ароматичні азосполуки. Загальна формула ароматичних азосполук Аг—К=К—Аг'. Назви азосполук з однаковими вуглеводневими радикалами складають з префікса азо- і назви вуглеводню. Положення замісників у вуглеводневих радикалах позначають цифрами або локантами орто-, мета- і пара-:
НО
азобензен 2-гідрокси-4' -метилазобензен; о-гідрокси-и' -метилазобензен
Азосполуки з різними вуглеводневими радикалами при азогрупі розглядають як похідні вуглеводню з більш складною структурою, що містить як замісник ареназогрупу Ar—N=N—: N0,
2-бензеназонафтален 1-(4'-нітробензеназо)-2-нафтол Азосполуки, як і інші сполуки, що містять угруповання —N=N—, існують у вигляді двох геометричних ізомерів — син- (цис-) і анти- (транс-). Так, азобензен (т. пл. 68 °С) є анти -ізомером. При опромінюванні УФ-світлом він переходить у син -ізомер (т. пл. 71 °С): N=N \
анвш-азобензен; £-азобензен син-азобензен; 2- азобензен Син -ізомер нестабільний і швидко перетворюється в анти -ізомер. Глава 21 312Г СПОСОБИ ДОБУВАННЯ реакція азосполучення(див. с. 309). це найважливіший спосіб добування азосполук і широко застосовується в промисловості. Відновлення нітроаренів у лужному середовищі.При відновленні нітроаренів у лужному середовищі азосполуки утворюються як проміжні продукти (див. с. 275). Проте за певних умов, зокрема під дією цинку в лужному середовищі, процес відновлення може бути зупинений на стадії утворення азосполуки: азобензен ХІМІЧНІ ВЛАСТИВОСТІ Реакційна здатність азосполук зумовлена наявністю в їх структурі азогрупи —N=N—. Азосполуки виявляють слабкі основні властивості за рахунок не-поділених пар електронів на атомах Нітрогену азогрупи. Азогрупа протонується в присутності мінеральних кислот: С6Н5—N=14— С6Н5 + НС1^^ С6Н5~ N=14— С6Н5 + СГ Азосполуки за участі азогрупи вступають у реакції окиснення та відновлення. Під дією пероксикислот азосполуки окиснюються з утворенням азокси-сполук: к—сооон+
О" азобензен азоксибензен При відновленні азосполук за м'яких умов (дія цинку в розчинах лугів) утворюються гідразосполуки: [Н] (2п + ШОН) с6н5—к=м—с6н5 -------- *- с6н5—мн—мі—с6н5 азобензен гідразобензен Відновлення станум(II) хлоридом у середовищі хлоридної кислоти приводить до утворення ариламінів:
4-метшгазобензен л-толуїдин анілін Азосполуки — це кристалічні речовини, забарвлені в жовтий, оранжевий, червоний, синій та інші кольори і можуть бути використані як барвники, індикатори тощо. Низку азосполук використовують у медичній практиці як хіміотерапевтичні засоби. Салазопіридазин, салазодиметоксин застосовують для лікування захворювань товстого кишечнику — неспецифічного виразкового коліту і хвороби Крона. ДІаЗО-та аЗОСПОЛУКи
осн,
Поиск по сайту: |






 -N2; -Н3РО3; -НС1
-N2; -Н3РО3; -НС1










 -Н20
-Н20




 Оскільки діазокатіон відносно слабкий електрофіл, він здатний реагувати тільки з дуже реакційноздатними ароматичними сполуками. До них належать сполуки, щомістять в ароматичному ядрі сильні електронодонорні групи: —OH, —H2, —HR, —R2. Зазначені замісники за рахунок виявлення +M- ефекту збільшують електронну густину у бензеновому ядрі і тим самим активують його в реакціях SE. Заміщення йде головним чином у пара-положення відносно активуючої групи, якщо ж це положення зайняте, відбувається орто-заміщення.
Оскільки діазокатіон відносно слабкий електрофіл, він здатний реагувати тільки з дуже реакційноздатними ароматичними сполуками. До них належать сполуки, щомістять в ароматичному ядрі сильні електронодонорні групи: —OH, —H2, —HR, —R2. Зазначені замісники за рахунок виявлення +M- ефекту збільшують електронну густину у бензеновому ядрі і тим самим активують його в реакціях SE. Заміщення йде головним чином у пара-положення відносно активуючої групи, якщо ж це положення зайняте, відбувається орто-заміщення.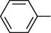








 6 5 6 5 -к-СООН |
6 5 6 5 -к-СООН |

