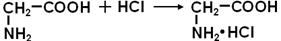|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Класифікація амінокислот
1) за кислотно-лужними властивостями амінокислоти поділяють на: - неполярні: пролін, валін, аланін, триптофан, фенілаланін, ізолейцин, метіонін, лейцин; - полярні: гліцин, цистеїн, аспарагін, глутамін, треонін, серин, тирозин; - кислотні: глутамінова та аспарагінова кислоти; - основні: гістидин, лізин, аргінін. 2) за біологічним значенням розрізняють: - незамінні: валін, ізолейцин, лейцин, треонін, лізин, метіонін, триптофан, фенілаланін (у дітей незамінними є гістидин та аланін) – тобто такими, які організм людини не синтезує сам, а має одержувати з їжею; - напівзамінні: аргінін, гістидин, тирозин (частково синтезуються). - замінні: глутамінова кислота, аспарагінова кислота, аланін, глутамін, гліцин, аспарагін, пролін, серин, цистеїн. 3) залежно від природи радикала (R) – амінокислоти діляться на аліфатичні, ароматичніта гетероциклічні: Класифікація α-амінокислот
Ізомерія · вуглецевого скелету · положенням функціональних груп, · для α-амінокислот характерна оптична (дзеркальна) ізомерія. Всі α-амінокислоти, крім гліцину, оптично активні. Наприклад, аланін має один асиметричний (хіральний) атом вуглецю (відзначений зірочкою). Асиметричний атом – це атом карбону, який з’єднаниний з чотирма різними замісниками.
тобто, існує у вигляді оптично активних енантіомерів:
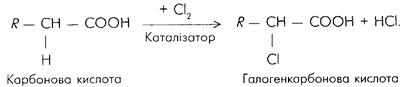
Всі природні α-амінокислоти відносяться до L– ряду. Фізичні властивості Амінокислоти є безбарвними кристалічними речовиновинами, легко розчинними у воді, гірше — в органічних розчинниках. Деякі з них є солодкими на смак. Температури плавлення амінокислот як цвіттер-йонів є досить високими, деякі з них плавляться з розкладом. Природні α-амінокислоти (крім гліцину) є оптично активними речовинами Одержання амінокислот Найбільш важливими є способи одержання амінокислот з галогенкарбонових кислот. Синтез відбувається в 2 стадії:
Хімічні властивості 1) Кислотна (–COOH) і основна (–NH2) групи в молекулі амінокислоти взаємодіють одна з одною, утворюючи внутрішні солі (біполярні йони). Положення рівноваги залежить від pH середовища. В ізоелектричній точці (ІЕТ), коли концентрація катіонів та аніонів рівні, конценотрація біполярного іона максимальна і рух його в електричному полі не відбувається. Наприклад, для гліцину
2) α-амінокислоти є амфотерними сполуками · утворюють солі з лугами (pеакція заміщення ):
натрієва сіль гліцину · утворюють солі з кислотами (реакція приєднання )
3) α-Амінокислоти вступають одна з одною в реакцію поліконденсації (реакція між СООН групою першої кислоти і NH2 групою другої кислоти). Продукти такої конденсації називаються ПЕПТИДАМИ. При взаємодії двох амінокислот утворюється дипептид:
При конденсації трьох амінокислот утворюється трипептид і т.д.
Загальнi хiмiчнi властивостi амiнокислот визначаються реакцiйною здатнiстю їх рiзних функцiональних груп: За карбоксильною групою вони утворюють солi, складнi ефіри, ангiдриди, галогенангiдриди, амiди кислот. У реакцiях декарбоксилування утворюються спирти з гiдроксикислот та амiни з амiнокислот. За групою –NН2 вiдбуваються реакцiї ацилування, алкiлулування, дезамiнування. Відношення до нагрівання. 1. При нагріванні α-амінокислот, відбувається міжмолекулярне дезамінування і утворюється дикетопіперазин.
2. b-амінокислоти відщеплюють амоніак і дають амонійну сіль ненасиченої кислоти. Причиною такої реакції є рухливість водневих атомів в сусідстві з карбоксильною групою:
3.g-,d-амінокислоти уворюють при нагріванні внутрішні аміди -лактами
Пептиди. Білки
Умовно вважають, що пептиди містять в молекулі до 100 (відповідає молекулярній масі до 10000), а білки – понад 100 амінокислотних залишків (молекулярна маса від 10000 до декілька мільйонів).
Поиск по сайту: |













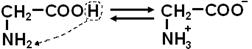 біполярний йон
біполярний йон